


2025年美国临床肿瘤学会(ASCO)年会于5月31日在芝加哥盛大启幕,为期 4 天的会议以“Driving Knowledge to Action: Building a Better Future(知识化为行动:共创美好未来)”为主题,聚焦全球肿瘤治疗领域的最新研究进展和创新转化成果。ADC 药物仍旧是备受关注的热门领域,在遴选出的 184 项相关摘要及口头报告中,中国企业贡献了其中 89 项(占比为 48.4%)。从早期疗效探索到关键临床试验(pivotal trial),中国的创新力量正在积极探寻新的靶点或靶点组合、拓展免疫治疗联合策略推进治疗线数前移,并不断突破适应症边界,在多个方向上取得了重要进展和突破。本文将回顾本届 ASCO 年会在 ADC 药物的临床试验设计与成果转化方面的主要亮点,深入剖析其科学价值与临床应用潜力,以期在后续的 CRO 工作中为行业发展贡献更多的 Actions。
全文共:8879 字 36 图
预计阅读时长:30 分钟
前言
2025年美国临床肿瘤学会(ASCO)年会再次彰显了抗体偶联药物(ADC)在肿瘤治疗领域的重要地位。亮点集中在三个维度:
多种ADC技术平台的成熟与加速迭代、双抗ADC及新靶点ADC的百花齐放,提升了临床精准治疗的疗效;
在传统治疗存在瓶颈的领域取得了突破,针对难治性脑转移肿瘤、铂耐药复发卵巢癌等难题探索出新策略,多种 ADC 尝试开拓“ADC+IO” 联合疗法,已上市药物积极向一线治疗拓展并拓宽适应症;
中国创新力量的国际化突围 —— 在 40 项 ADC 相关口头报告中,中国贡献了 11 项关键研究,多家国内企业携相关产品亮相并成为全球 ADC 开放浪潮中的重要参与者。
本文将纵览本届大会ADC研发项目全景,重点关注处于关键临床阶段的产品,并对取得靶点突破与完成概念验证的创新产品进行系统梳理。立足行业前沿趋势,关注临床疗效数据安全性特征、新兴治疗策略及疗效预测手段。同时,为从事非临床研究的同行工作者提供从临床到非临床“以始为终,以因推果”的转化研究提供参考。
★ 文章导览 ★
01 | ASCO 2025 —— ADC 项目全景 |
02 | 关键性临床试验阶段 ADC 项目解析 |
03 | 靶点创新与概念验证 |
04 | ADC 治疗新趋势 |
05 | 结语 |
ASCO 2025 —— ADC 项目全景
今年的 ASCO 年会俨然已成为 ADC 研发进展的核心展示平台。
在所有药物品类的 432 项口头报告里,ADC相关研究独占 9.25%,与去年相比增幅达 48%,反映了该领域前所未有的研发活力。本节着重关注了本次大会上处于研发阶段、尚未上市的ADC产品的进展,并依据适应症领域和靶点进行了分类汇总:

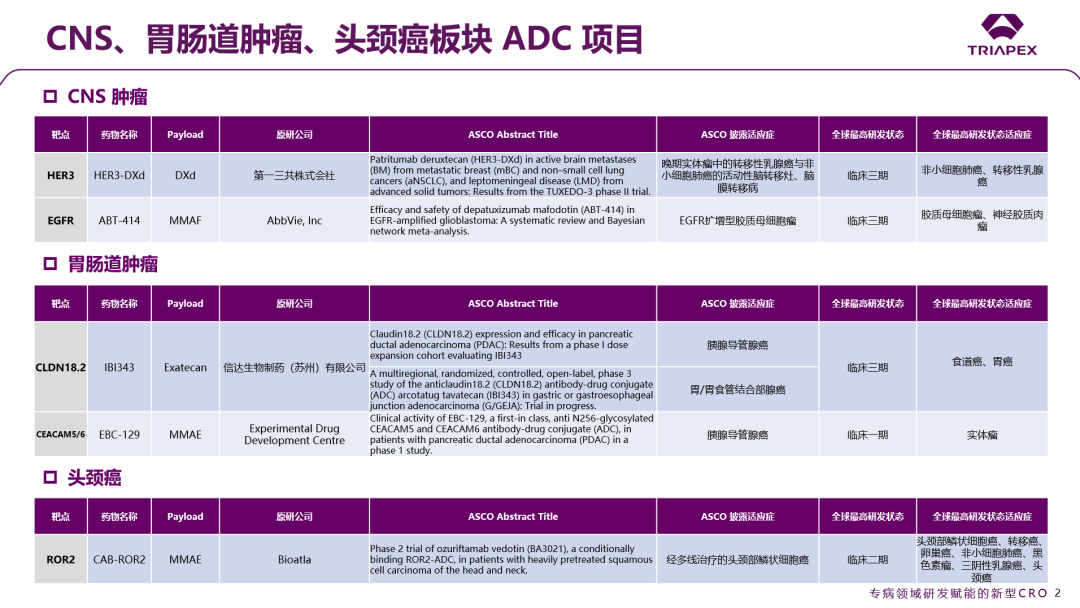
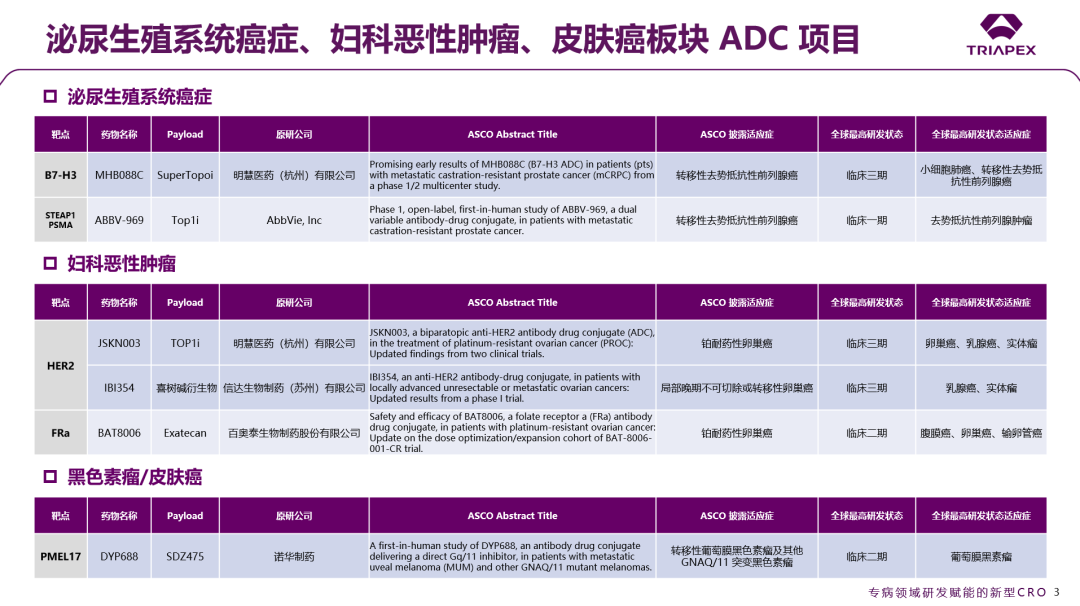
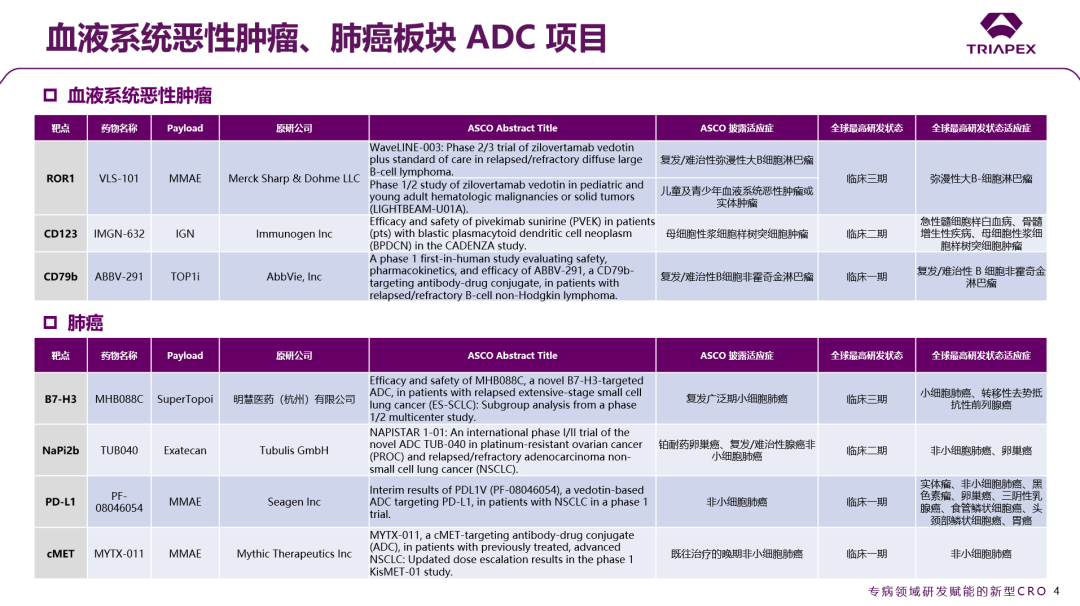
图1. 依据疾病治疗领域的 ADC 分类
除此之外,大会还专门设立了Developmental Therapeutics这一分类,突破传统的按疾病器官系统分类的限制,聚焦药物的作用机制研究,专注于新药的早期临床探索。该分类下汇集了“篮式试验”(Basket Trial,即纳入携带同一分子靶点的不同瘤种患者)和“伞式试验”(Umbrella Trial,即在单一瘤种框架下平行评估多种针对不同分子靶点的药物),整合并强化了基础肿瘤生物学的研究内容,为新靶向药物研究提供了普适性更强的转化研究交流平台。本节也对ASCO大会入选Developmental Therapeutics的ADC项目进行了汇总,旨在提供更全面的视角,来映射当前肿瘤学前沿动态及新药研发趋势。
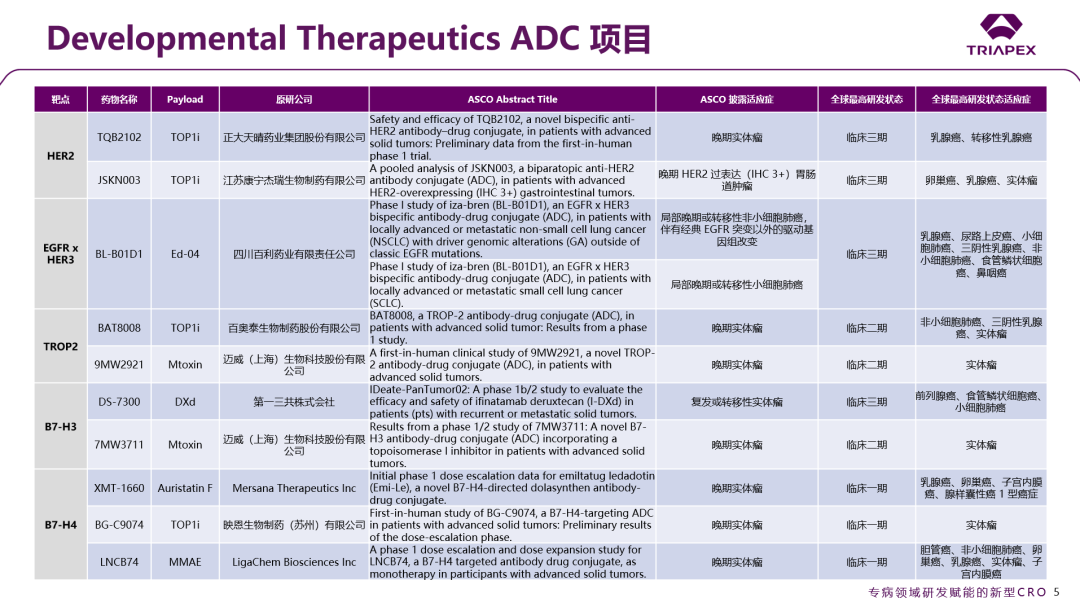
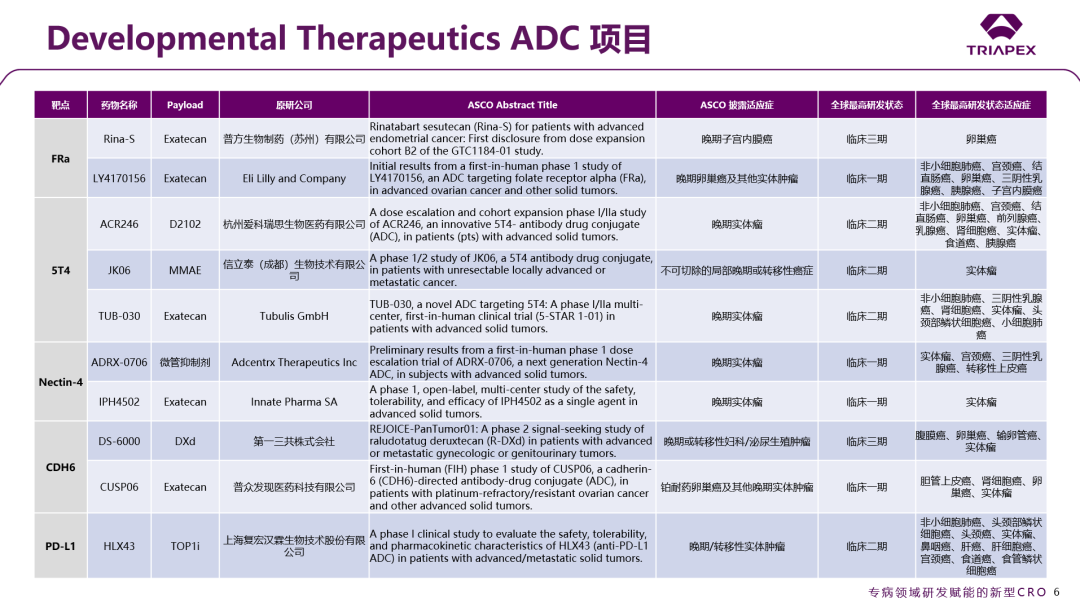
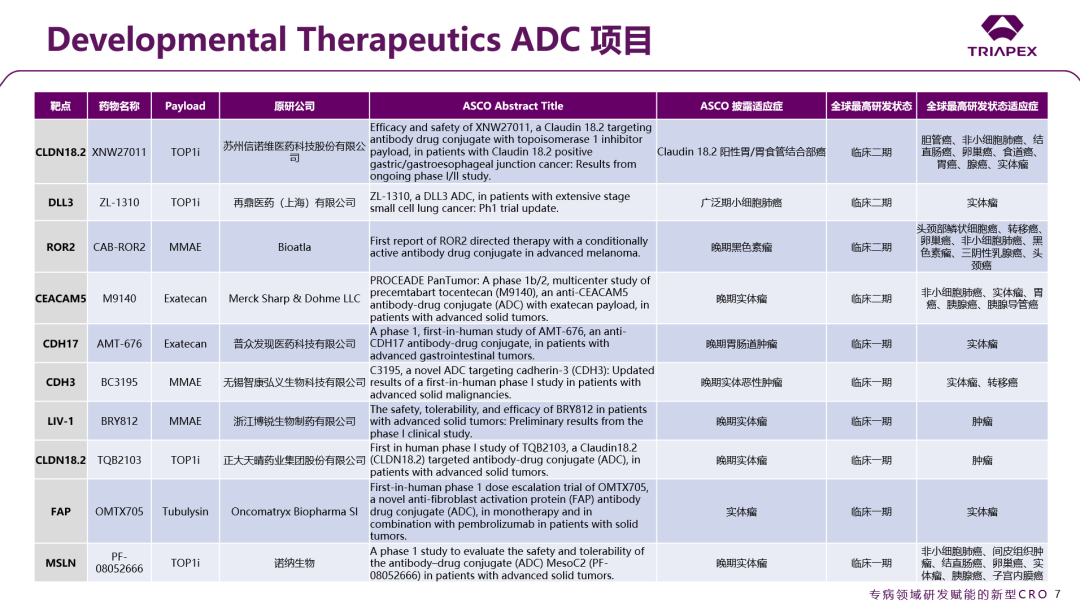
图2. Developmental Therapeutics 分类下的 ADC 项目
随着全球 ADC 研发进入深水区,中国药企凭借靶点创新、技术迭代与临床策略优化的多重突破,正逐步由参与者向引领者转变,并在全球 ADC 药物研发格局中占据重要地位。
临床策略创新带动老靶点药物实现临床突破
ASCO 披露的 ADC 项目,目前超过 15 个项目进入关键临床试验阶段,涵盖EGFR/HER3(百利天恒BL-B01D1)、HER2(正大天晴TQB2102)、TROP2(信达生物IBI130)等经典靶点。
联合疗法突破难治亚型的治疗困境
基于对耐药机制的预测及破解,通过联合增效(如ADC+IO,ADC+靶向治疗)为传统疗法无效患者提供新选择。
技术迭代实现源头创新
中国药企的 ADC 技术平台正在从“引进改良”过渡到“源头创新”。以宜联生物TMALINTM平台为例,其核心突破在于肿瘤微环境响应型连接子设计,通过酶控特异性释放毒素,降低系统性毒性。2025年 ASCO 上,该平台技术成果集中亮相:再鼎医药的DLL3 ADC(ZL-1310)、复宏汉霖的PD-L1 ADC(HLX43)、信诺维的CLDN18.2 ADC(XNW27011)均基于此平台开发。再加上宜联自研管线中的YL201(B7-H3 ADC)、YL202(HER3 ADC)、YL205(Napi2b ADC)及YL242(VEGF ADC),TMALIN™平台已推动 12 款 ADC 进入临床阶段。
以上进展只是众多国内 ADC 研发进展的冰山一角,但足以彰显中国 ADC 研发已从“跟跑”迈向“并跑”,并在部分领域实现“领跑”。未来,源头创新和精准治疗将进一步定义 ADC 的研发方向。
关键性临床试验阶段 ADC 项目解析
本次 ASCO 大会公布的关键性临床试验阶段 ADC 项目数量众多,其中多个项目展示了非常亮眼的临床数据和潜力。鉴于本文篇幅限制和为了立足于主题,我们依据临床价值、创新性及治疗领域关注度等维度进行考量,最终聚焦于以下两个项目进行深入解析。需要特别指出的是,尽管未能在本文中展开讨论,未纳入讨论的项目同样承载着重要的科学意义,并为解答未被满足的临床需求提供了潜在突破方向。未来,随着临床研究的推进,相信还会有更多具备显著临床价值的ADC项目进入学术界的视野。
2.1
Becotatug Vedotin
(全球最高研发状态:申请上市)
Becotatug Vedotin(MRG003)是由乐普生物自主研发的靶向EGFR的 ADC 药物,也是该公司临床进展推进最快的核心 ADC 产品。早期临床研究显示,MRG003在头颈部肿瘤(尤其鼻咽癌)中疗效显著。其I/II期试验数据表明,对于铂类化疗及PD-(L)1抑制剂治疗失败的R/M 鼻咽癌患者,该药表现出持久的抗肿瘤活性。
此次大会中,MRG003凭借其II期关键临床试验(NCT05126719)入选了备受瞩目的重磅突破性摘要(LBA)。此项研究具有填补临床空白的里程碑意义 —— 首次为化疗和PD-(L)1抑制剂失败的复发/转移性鼻咽癌患者提供高效治疗方案。下文将重点解析该研究的试验设计、核心终点及数据结果,揭示其临床实践的科学价值。
主要入排标准:经组织学或细胞学确诊的鼻咽癌, EGFR表达状态不限;处于复发或转移阶段;既往至少接受过两线化疗及抗PD-(L)1抑制剂治疗失败。
给药方案和分组:随机分配至MRG003组(2.3 mg/kg, Q3W)与化疗对照组 —— 卡培他滨(1000 mg/m2, Q3W)、多西他赛(75 mg/m2, Q3W);化疗对照组的患者在疾病进展后允许交叉接受 MRG003 治疗。
主要终点:客观缓解率(ORR)和无进展生存期(PFS),以及总生存期(OS)。
入组人数:238(预期),172(截止)

图3. NCT05126719临床试验设计[1]
临床试验结果
截至2024年6月30日的数据分析:
ORR:经盲态独立中心评估(BICR),MRG003组ORR达30.2%,显著高于化疗组的11.5%(近3倍提升)
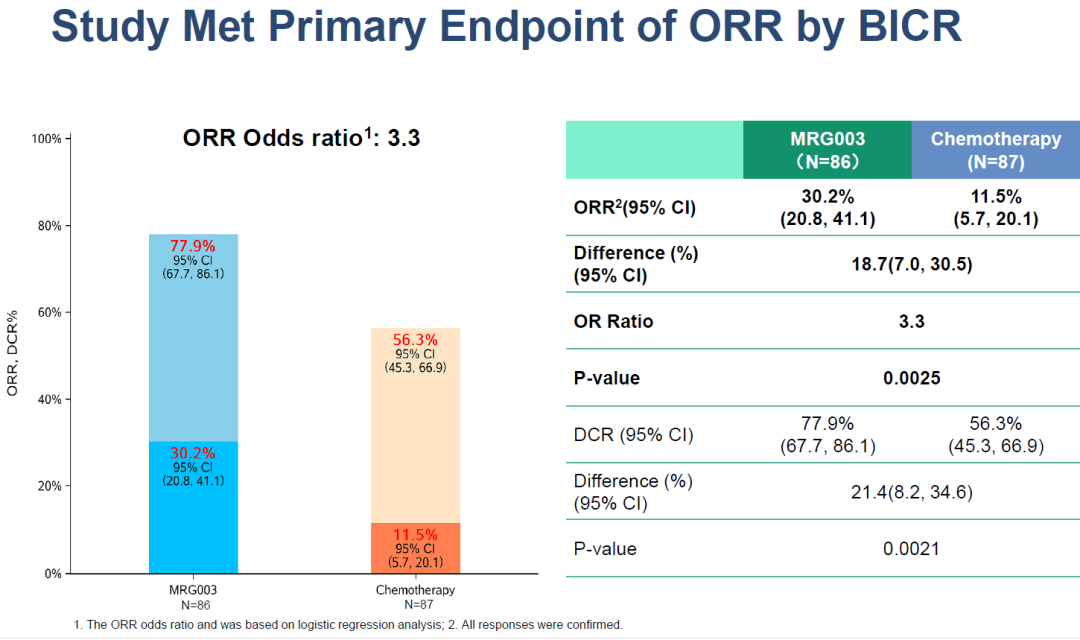
图4. NCT05126719 主要终点 ORR 数据
PFS:MRG003组中位PFS为5.82个月,较化疗组(2.83个月)延长105%,疾病进展或死亡风险显著降低37%(HR=0.63;95% CI 0.44–0.91;P=0.0146)
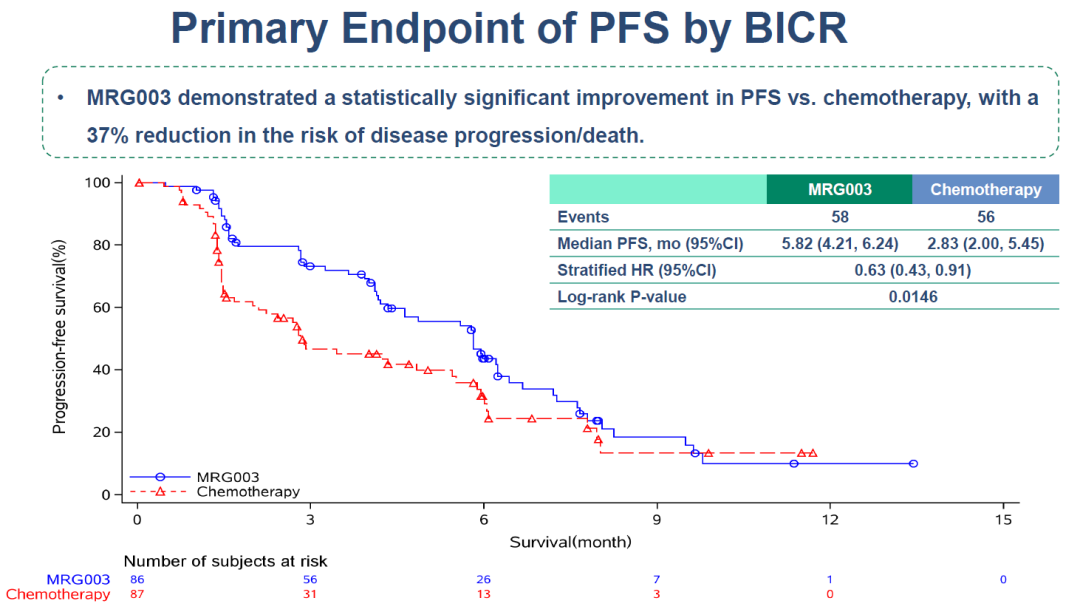
图5. NCT05126719 主要终点 PFS 数据
截至2024年6月30日
截至2024年12月30日的期中分析:
OS:MRG003组中位OS为17.08个月,化疗对照组为11.99个月(HR=0.73;95% CI 0.52–1.03)。校正交叉治疗影响后:两组OS风险比优化至0.59(95% CI 0.37–0.93),生存获益趋势进一步增强。
安全性特征:MRG003组与化疗组的治疗相关不良事件(TRAE)总发生率相近,≥3级TRAE发生率:MRG003组45.3% vs 化疗组50.6%;大部分不良事件为1~2级,总体安全可控。

图6. NCT05126719 安全性特征
2.2
Izalontamab brengitecan
(全球最高研发状态:临床三期)
Izalontamab brengitecan(BL-B01D1)是由百利天恒自主研发的首创(First-in-Class)靶向EGFR/HER3双抗ADC。其创新性在于独特的双特异性结构,通过协同阻断EGFR与HER3介导的异常促癌下游信号通路,显著增强抗肿瘤活性。BL-B01D1的核心优势体现在以下方面:双靶点设计可克服单靶点耐药性,针对EGFR/HER3共表达瘤种(如尿路上皮癌、三阴性乳腺癌),显著提升了治疗响应率。作为目前全球进展最快、且唯一进入临床III期的靶向EGFR/HER3双抗ADC,BL-B01D1在新一代ADC研发领域具有重要的地位,也因此成为众多双抗ADC药物开发的标杆或超越的目标。
截至今年3月,BL-B01D1已在全球同步推进9项III期关键注册临床试验,覆盖小细胞肺癌、非小细胞肺癌、乳腺癌、食管鳞癌、鼻咽癌及尿路上皮癌六大高发实体瘤领域。凭借突出的临床价值,已获得NMPA授予3项突破性治疗药物认定(BTD),涵盖晚期NSCLC(EGFR突变/野生型)、局部晚期/转移性三阴性乳腺癌、及晚期食管鳞癌适应症。这些认定充分体现了其显著的临床价值,有望加速该药物在中国市场的上市进程。
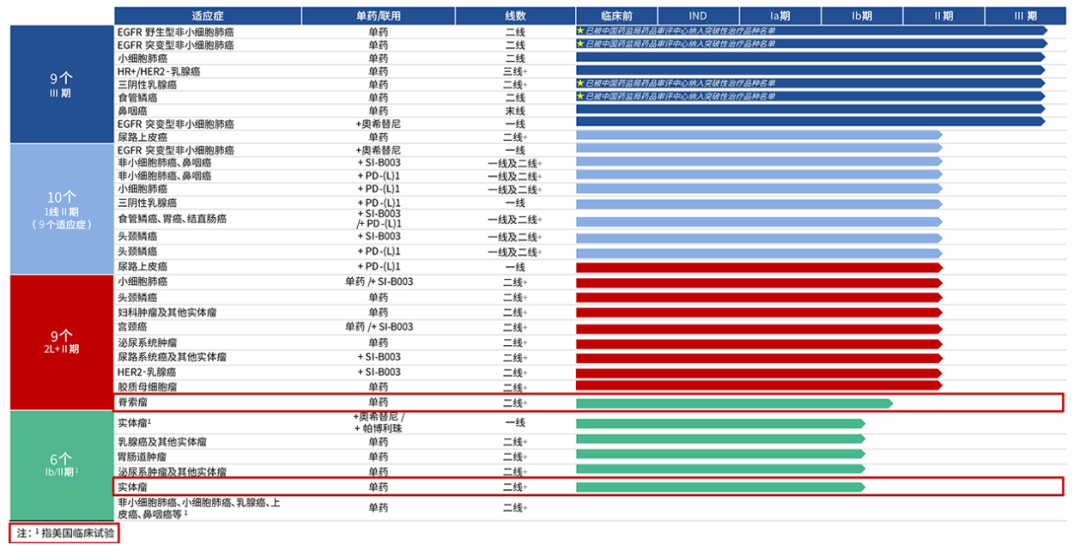
图7. BL-B01D1临床研发进展[2]
在本届ASCO大会上,尽管未入选LBA,BL-B01D1仍凭借其两项I期临床研究的突破性数据引发高度关注和讨论。
I.Iza-bren(BL-B01D1)在携带经典EGFR突变外驱动基因组改变(GA)的局部晚期或转移性非小细胞肺癌(NSCLC)患者中的I期研究(NCT05194982)
Phase I study of iza-bren (BL-B01D1), an EGFR x HER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic non-small cell lung cancer (NSCLC) with driver genomic alterations (GA) outside of classic EGFR mutations.
主要入排标准:携带EGFR 20号外显子插入突变、非经典EGFR突变、HER2突变、ALK重排、ROS1重排、BRAF突变(V600E及其他)、KRAS突变(G12C及其他)、SMARCA4突变、MET 14号外显子跳跃突变、RET融合及NTRK融合的患者;既往接受过标准靶向治疗后疾病发生进展;既往化疗线数≤1。
给药方案和分组:2.5 mg/kg;D1、D8,Q3W
主要终点:安全性
入组人数:96(预期),83(截止)

图8. NCT05194982 临床试验设计[3]
临床试验结果
疗效亮点:该药物在伴不同驱动基因变异的晚期NSCLC患者中展现出深度、持久的抗肿瘤活性。
总体人群:ORR 46.2%(确认ORR 39.7%),疾病控制率(DCR)85.9%;中位缓解持续时间(DoR)尚未达到,PFS为7.0个月,OS数据未达到。
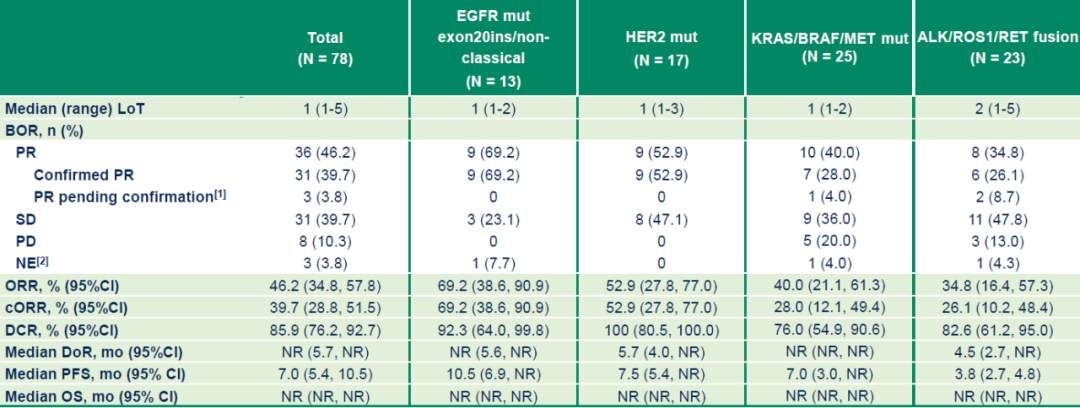
图9. NCT05194982 总体受试者人群疗效数据
关键亚组
EGFR exon20插入/非经典EGFR突变:确认ORR(cORR)69.2%,DCR 92.3%;中位DoR未达到,中位PFS达10.5个月。
HER2突变:cORR 52.9%,DCR 100%;中位DoR 5.7个月,中位PFS 7.5个月。
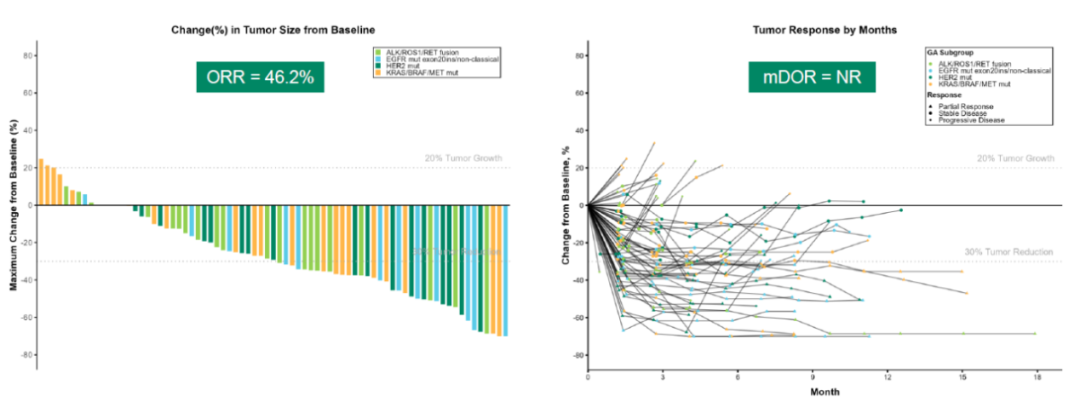
图10. NCT05194982 肿瘤治疗反应特征
安全性特征:治疗耐受性良好,≥3级TRAEs发生率较低(2.4%停药率),重度TRAEs以血液学毒性为主,可通过剂量调整及支持性治疗有效控制。
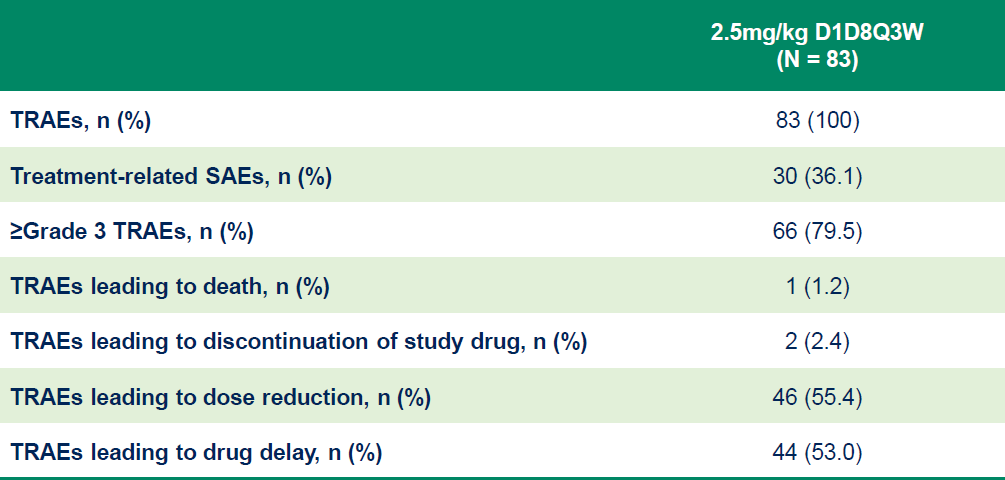
图11. NCT05194982 安全性特征
II.EGFR×HER3双抗ADC药物iza-bren(BL-B01D1)在局部晚期或转移性小细胞肺癌(SCLC)患者中的I期研究(NCT06500026)
Phase I study of iza-bren (BL-B01D1), an EGFR x HER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic small cell lung cancer (SCLC).
主要入排标准:局部晚期或转移性小细胞肺癌(SCLC)或其他实体瘤;ECOG 体力状态评分0-1分;根据RECIST v1.1标准存在可测量病灶;既往标准治疗失败或无可行治疗方案。
给药方案和分组:
递增阶段
队列A(D1、D8,Q3W):2.0 mg/kg → 2.5 mg/kg
队列B(D1 Q3W):4.5 mg/kg → 5.0 mg/kg
扩展阶段确定剂量
2.5 mg/kg(D1、D8,Q3W)
主要终点:剂量限制性毒性(DLT)、最大耐受剂量(MTD)以及II期推荐剂量(RP2D)
入组人数:96(预期),58(截止)
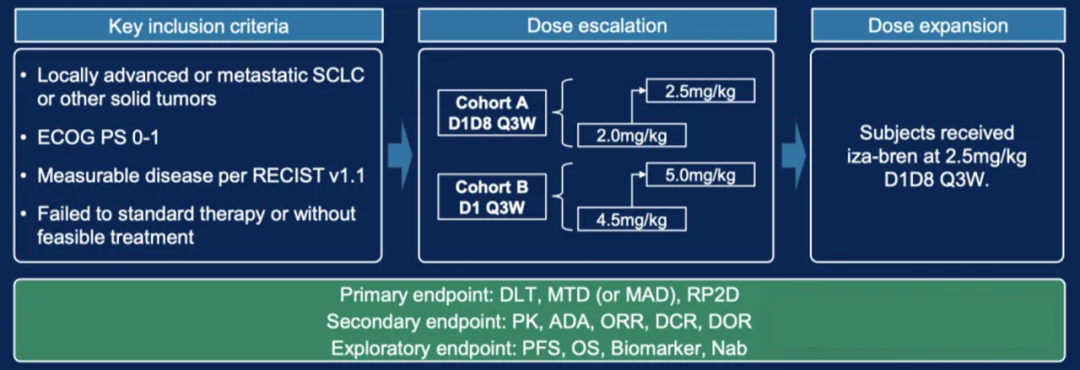
图12. NCT05194982 临床试验设计[4]
临床试验结果
疗效亮点:尽管SCLC患者预后极差且治疗选择有限,且近30年临床研究鲜获阳性生存获益,但在前线接受过伊立替康治疗的患者群体中,BL-B01D1仍展现出显著治疗价值
疗效分析(2.5 mg/kg D1D8 Q3W方案)
中位随访16.4个月,接受该剂量治疗的总体人群(n=52)显示出显著抗肿瘤活性:
客观缓解:ORR 55.2%(cORR 44.8%),DCR达81.0%
生存获益:中位DoR 4.6个月,中位PFS 4.0个月,中位OS 12.0个月
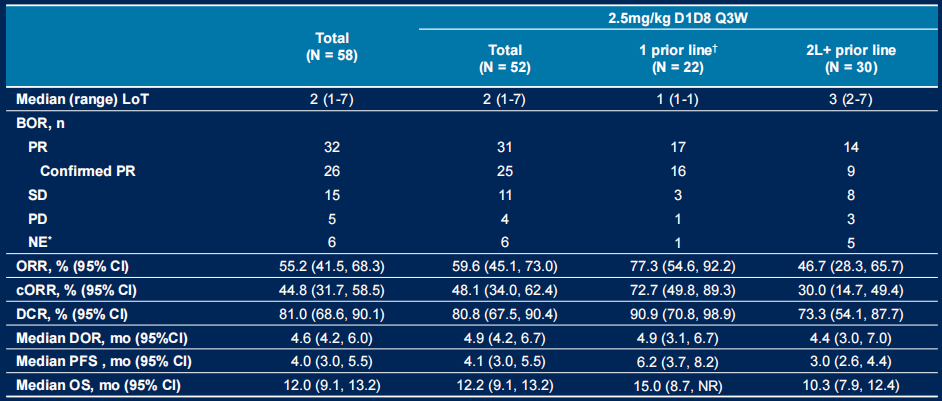
图13. NCT05194982 疗效分析数据
关键亚组疗效特征
既往仅接受一线PD-(L)1抑制剂联合含铂化疗治疗组(n=20)
呈现更高缓解率:ORR 80.0%(cORR 75.0%),DCR 90.0%
生存结局改善:中位DoR 5.6个月,中位OS延长至15.0个月
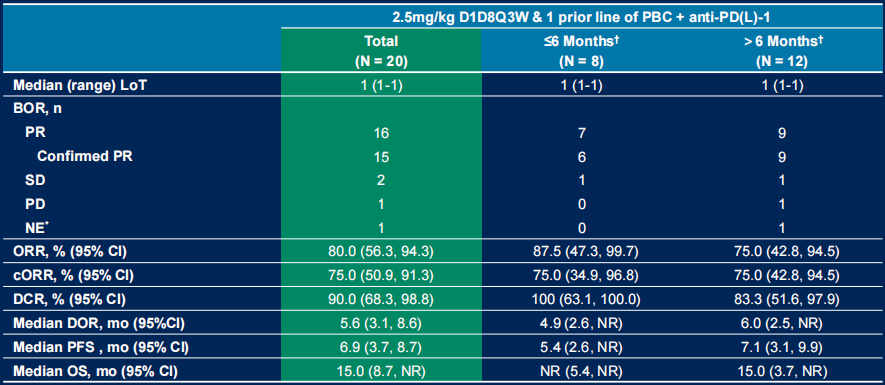
图14. NCT05194982 既往仅接受一线PD-(L)1抑制剂联合含铂化疗治疗组疗效数据
伊立替康治疗史分层分析
经治亚组(n=19):ORR 42.1%,DCR 68.4%,中位DoR 5.7个月,中位OS 10.3个月;
未经治亚组(n=33):ORR 69.7%,DCR 87.9%,中位DoR 4.9个月,中位PFS 5.4个月,中位OS 12.9个月
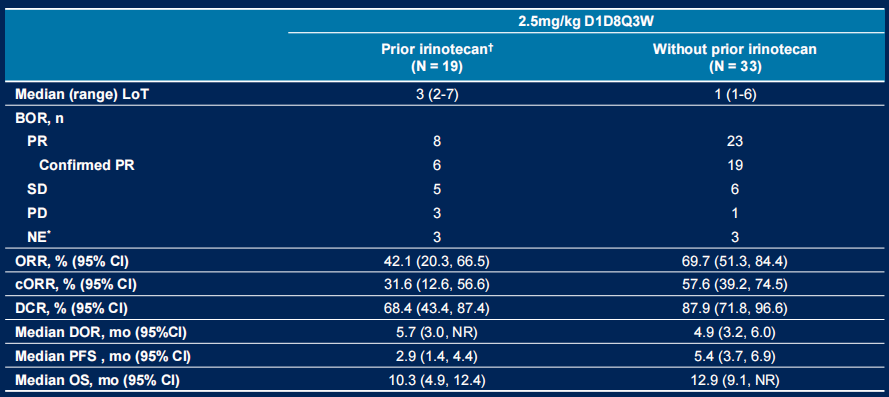
图15. NCT05194982 伊立替康治疗史亚组疗效数据
安全性特征
≥3级TRAEs主要表现为血液学毒性(主要为中性粒细胞减少相关事件),通过对症支持治疗措施及剂量调整可得到有效控制,导致治疗终止的TRAE发生率为12.1%。
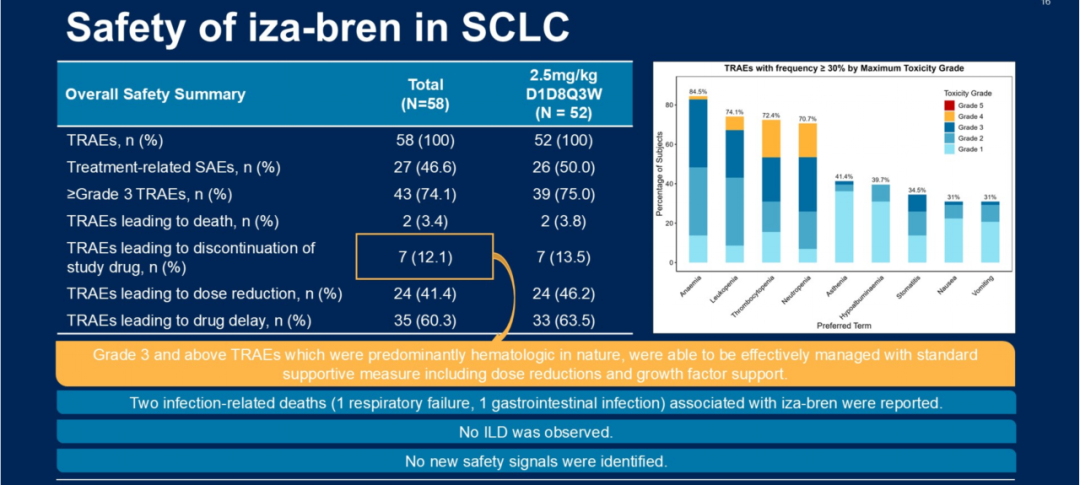
图16. NCT05194982 安全性特征
靶点创新与概念验证
本次ASCO年会还见证了ADC靶点格局的拓展变革。
除传统靶点(如HER2、TROP-2、EGFR)外,FRα、CDH6、SEZ6、LIV-1、FAP、PMEL17等一批较为新兴的治疗靶点正加速进入临床验证阶段。以FRα靶点为例,全球目前仅有一个ADC产品Elahere获批,10个在研项目处于临床阶段:普方生物的Rina-S已进入铂耐药复发性卵巢癌的III期临床,百奥泰BAT8006专注 II期优化,礼来LY4170156布局多癌种早期探索。
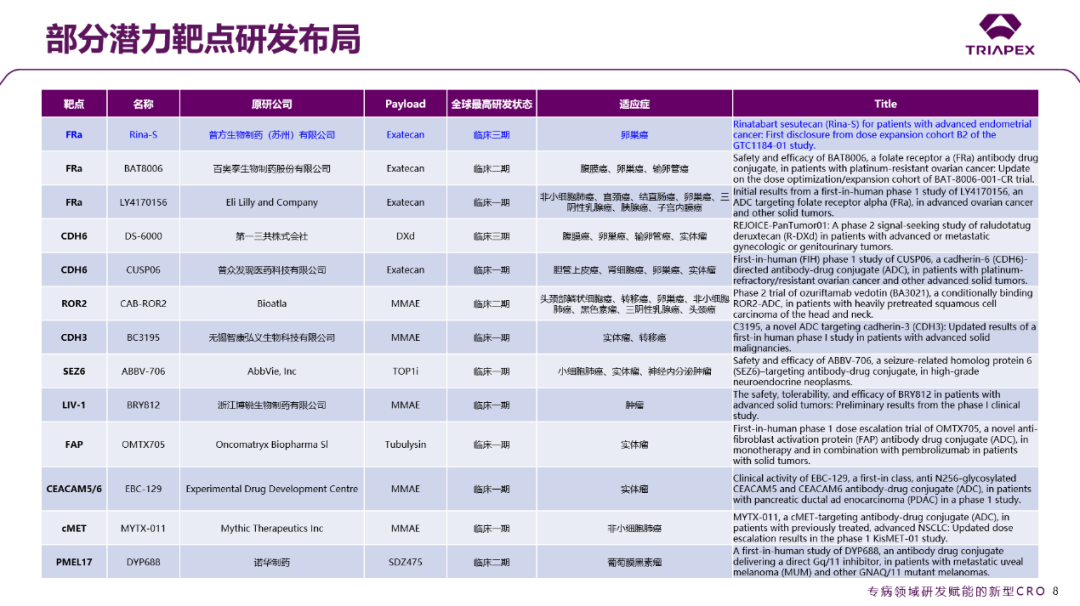
图17. ASCO大会公布部分潜力靶点研发布局汇总
大会发布的概念验证(Prove-of-Concept)项目数量较多。考虑到这些早期临床项目的入组患者较少,适应症多为泛瘤种,且患者筛选标准各异,后期临床研发存在较大不确定性,因此,笔者在此重点关注已进入临床III期、并在本次大会公布其I/II期数据的Rina-S项目。
对于经PD-(L)1抑制剂联合化疗治疗失败后的晚期子宫内膜癌患者,现有单药化疗方案ORR常低于16%、中位PFS多不足5个月,预后极差且治疗选择匮乏。针对这一困境,Rina-S 应时而生,其I/II期临床RAINFOL-01(NCT05579366)公布的疗效数据逐步印证了其“best-in-class”的潜力,下文将会对RAINFOL-01的试验设计和结果进行解析:
主要入排标准:经组织学或细胞学确诊的转移性或不可切除型子宫内膜癌患者;既往接受过铂类化疗及PD-(L)1抑制剂治疗
给药方案和分组:100 mg/m² (n=22) 或 120 mg/m² (n=21)
主要终点:安全性和耐受性
入组人数:529(预期),43(截止)
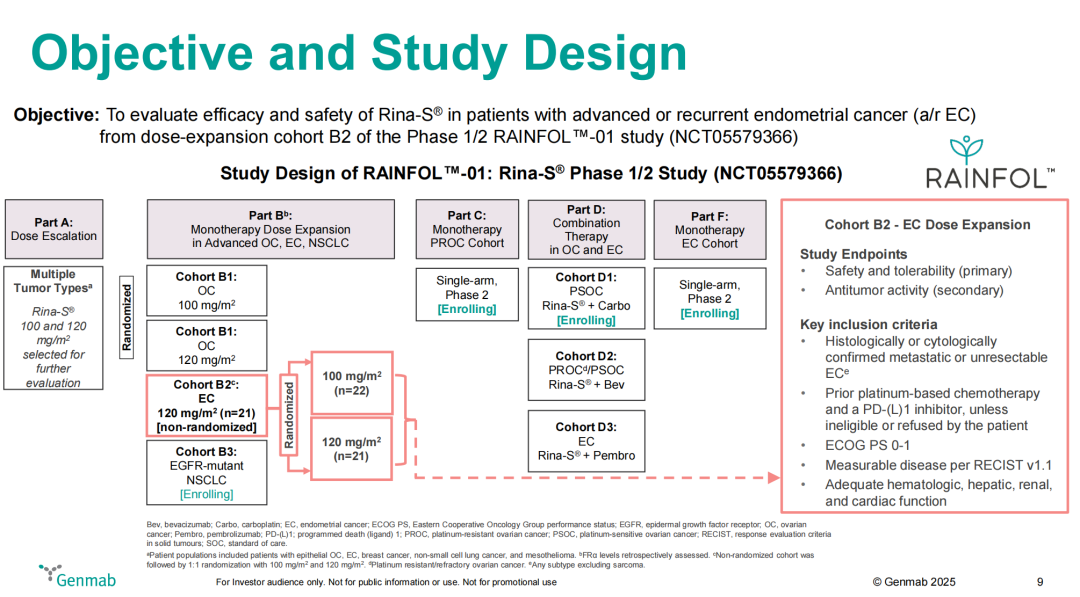
图18. NCT05579366 临床试验设计[5]
临床试验结果
疗效数据:100 mg/m²剂量组展现出显著优势,DCR达100%,而120 mg/m²组为81.8%;两组患者的DoR相似,100 mg/m²组81.8%;120 mg/m²组80.0%,剂量对缓解持久性无显著影响。

图19. NCT05579366 临床试验结果及数据
安全性数据:两个剂量组常见不良事件特征一致;严重毒性集中于高剂量组,3-4级TEAEs在两组均超过75% — 100 mg/m²组77.2%,120 mg/m²组76.1%,但120 mg/m²组的严重不良事件(SAEs)发生率为50%,高于100 mg/m²组的31.8%;均未观察到特殊毒性信号 — 眼毒性、神经病变、间质性肺疾病。
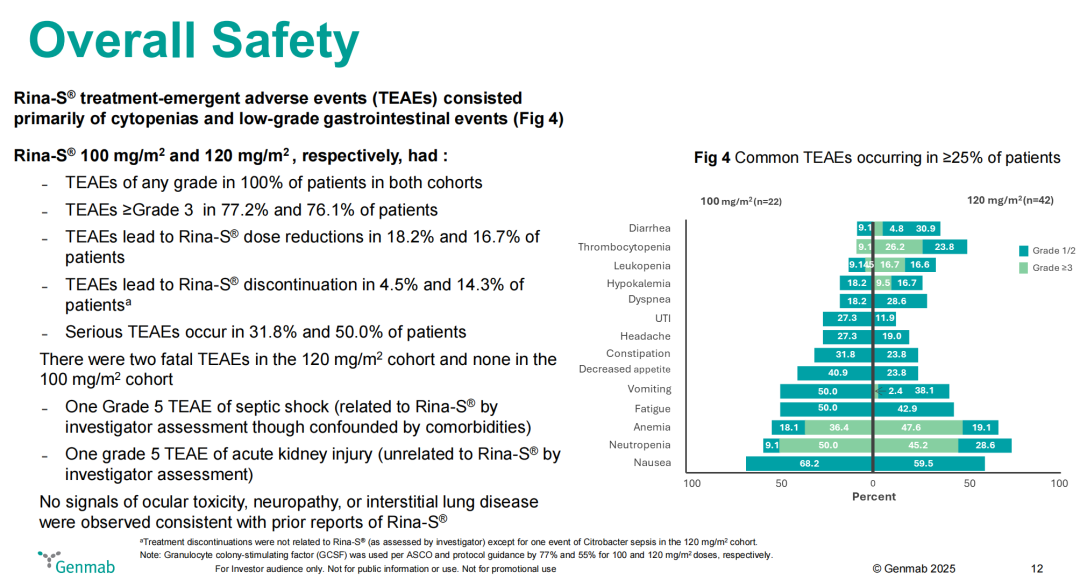
图20. NCT05579366 安全性特征
综上,新靶点和靶点组合的开发为ADC治疗领域带来了重要突破,特别是在解决未满足临床需求方面展现了巨大潜力。相较于成熟靶点所布局的热门赛道的高度竞争,新型靶点的探索不仅有助于避开研发资源的过度集中,还有望为患者提供更加多样化的治疗选择。然而,与其它治疗模式(Modality)类似,新兴靶点ADC药物的开发也面临临床特定的挑战:尽管能在一定程度上避开“红海”竞争,但其生物学特性尚未完全阐明,临床治疗获益的验证仍需更多数据的支持。以CDH17靶点为例,该靶点因在90%结直肠癌中的高表达成为理想的 ADC 候选靶点之一,但其在正常组织中的隐匿性表达也暗示了其潜在的脱靶毒性[6]。此外,许多看似理想的靶点在实验室研究阶段表现优异,却常因临床前模型与患者实际响应情况的差异而难以成功转化至临床开发(Translational gap)。
临床试验结果
截至2024年6月30日的数据分析:
ORR:经盲态独立中心评估(BICR),MRG003组ORR达30.2%,显著高于化疗组的11.5%(近3倍提升)
值得庆幸的是,新药研发的魅力恰恰体现在当人们能预见风险时仍勇敢地去尝试和探索。正如前文提及的Becotatug Vedotin和Izalontamab Brengitecan所展示的,某些看似难以成药的 ADC 靶点(如EGFR)也是有非常大的成药可能性的。5年之前,鲜有人相信靶向 EGFR 的单抗或双抗 ADC 能够实现临床应用。
ADC 治疗新趋势
4.1
ADC+IO联用疗法潜力及疗线前移
自2014年两款具有里程碑意义的靶向PD-1抑制剂 —— Nivolumab和帕博利珠单抗首次获批上市以来,已有数十个适应症相继获得监管机构的批准。然而,单药抗体疗法在肿瘤治疗中普遍存在疗效有限且患者易出现耐药复发的问题。
为突破这一瓶颈,近年来基于肿瘤免疫疗法(IO)的联合治疗已逐渐成为行业发展的重要趋势之一,并在临床研究中展现出显著潜力。今年的ASCO年会,ADC+IO的联合治疗策略更是备受关注。包括第一三共、默克、阿斯利康、恒瑞医药、荣昌生物、科伦博泰、迈威生物在内的多家企业,均公布了自研ADC产品与PD-1单抗联合用药的II-III期临床数据,其中不少组合展现了出色的治疗效果。在此处,对ADC+IO联合用药的项目也进行了汇总:
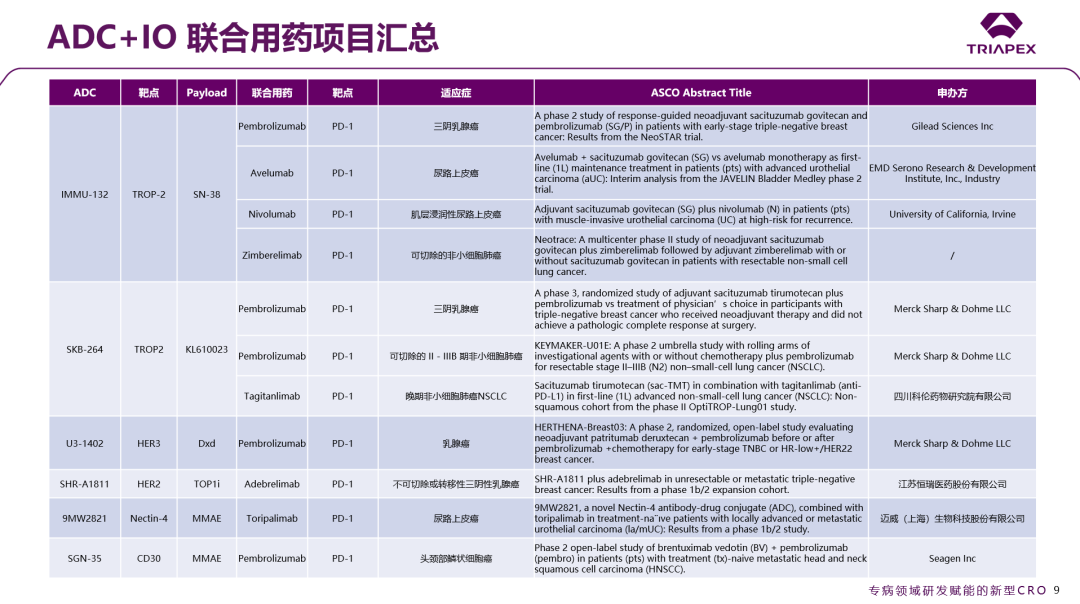
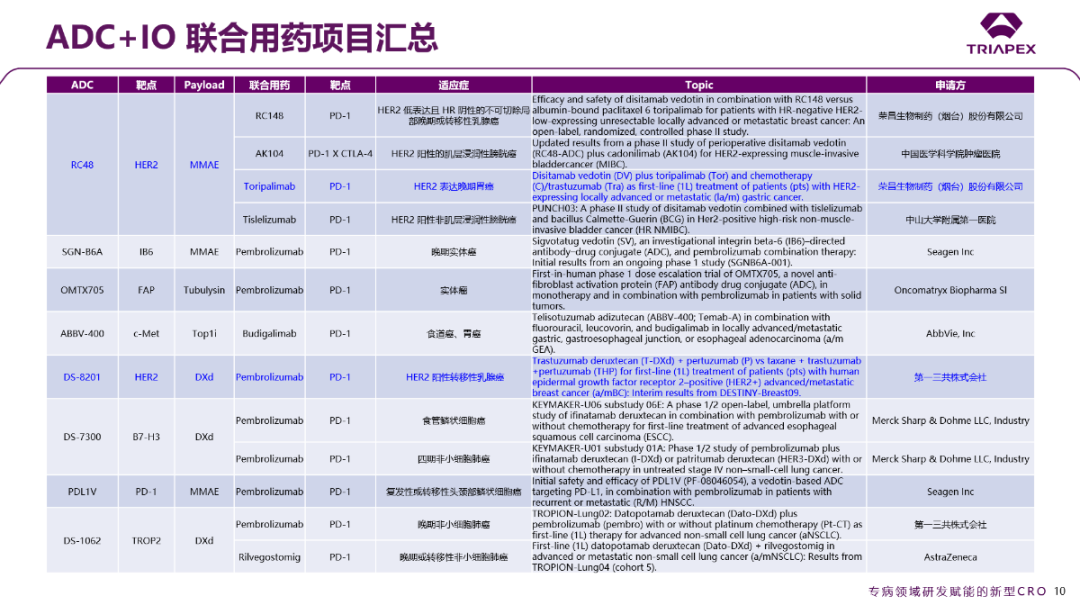
图21. ADC+IO 联合用药项目汇总
在此,我们重点介绍DS-8201(T-DXd)和帕博利珠单抗的联合用药研究DESTINY-Breast09。该III期临床研究首次采用T-DXd联合帕博利珠单抗作为HER2阳性晚期乳腺癌(HER2+mBC)的一线治疗方案,成功挑战先前一线标准治疗 —— 紫杉类药物联合曲妥珠单抗和帕妥珠单抗(THP方案),入选大会LBA。值得注意的是,既往T-DXd仅获批用于二线及二线以上治疗,此次是其首次进军一线治疗领域的探索。这一治疗线次的前移,要求临床试验设计在验证疗效的同时,精准管控去化疗方案的安全风险。为此,该研究采用了三臂随机设计(T-DXd+帕博利珠单抗 vs. THP vs. T-DXd单药),下文将系统阐述该试验的设计方案与临床数据:
主要入排标准:HER2阳性晚期或转移性乳腺癌患者;允许存在无症状/非活动性脑转移;允许接受过转移阶段一线内分泌治疗;无其他转移性乳腺癌既往全身治疗史
给药方案和分组:按1:1:1随机分组后予以T-DXd+安慰剂(T-DXd组)、T-DXd+帕妥珠单抗(T-DXd+P组)以及THP(THP组)标准治疗方案
主要终点:通过盲态独立中心评估(BICR)的PFS
入组人数:1157

图22. NCT04784715 临床试验设计[7]
临床试验结果
中位PFS率:T-DXd+P组:40.7个月;THP组:26.9个月;绝对获益:13.8个月(HR=0.56;95% CI 0.44-0.71;P<0.00001),疾病进展或死亡风险降低44%
2年PFS率:T-DXd+P组 70.1%;THP组 52.1%

图23. NCT04784715 主要终点PFS
亚组分析:所有预设亚组(包括既往治疗史、HR状态、PIK3CA突变状态)均显示T-DXd+P组PFS优于THP组
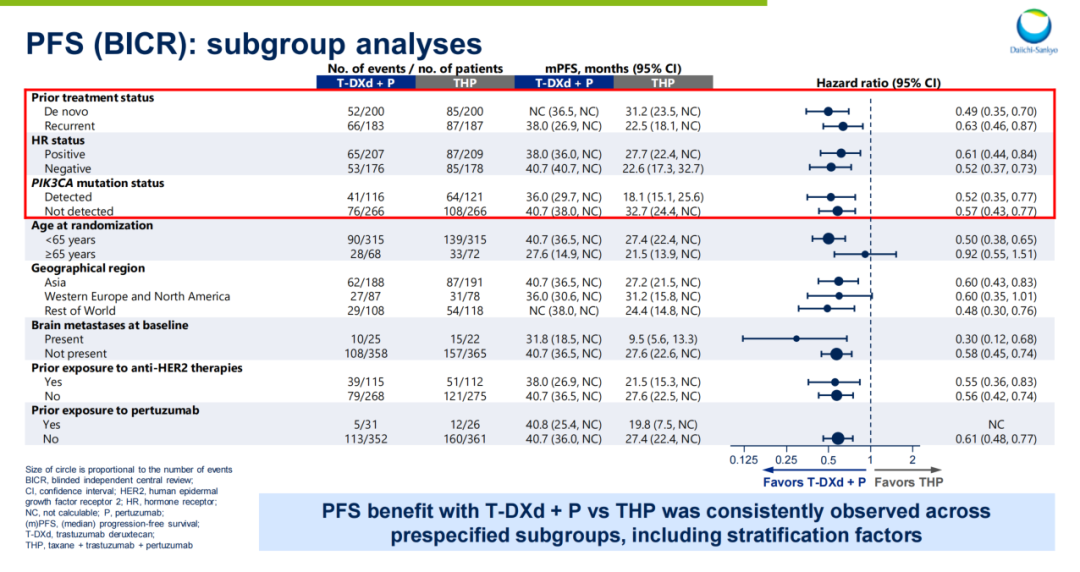
图24. NCT04784715 PFS亚组数据分析
治疗持续时间:T-DXd+P组中位治疗时间达21.7个月,显著长于THP组的16.9个月(延长4.8个月)
治疗终止率:因TEAEs终止治疗的比例在T-DXd+P组为20.7%,低于THP组的28.3%
安全性一致性:严重TEAEs发生率为T-DXd+P组27.0%,THP组25.1%,无显著差异,T-DXd+P组的AE与两种药物既往研究一致,未发现新的安全性信号。
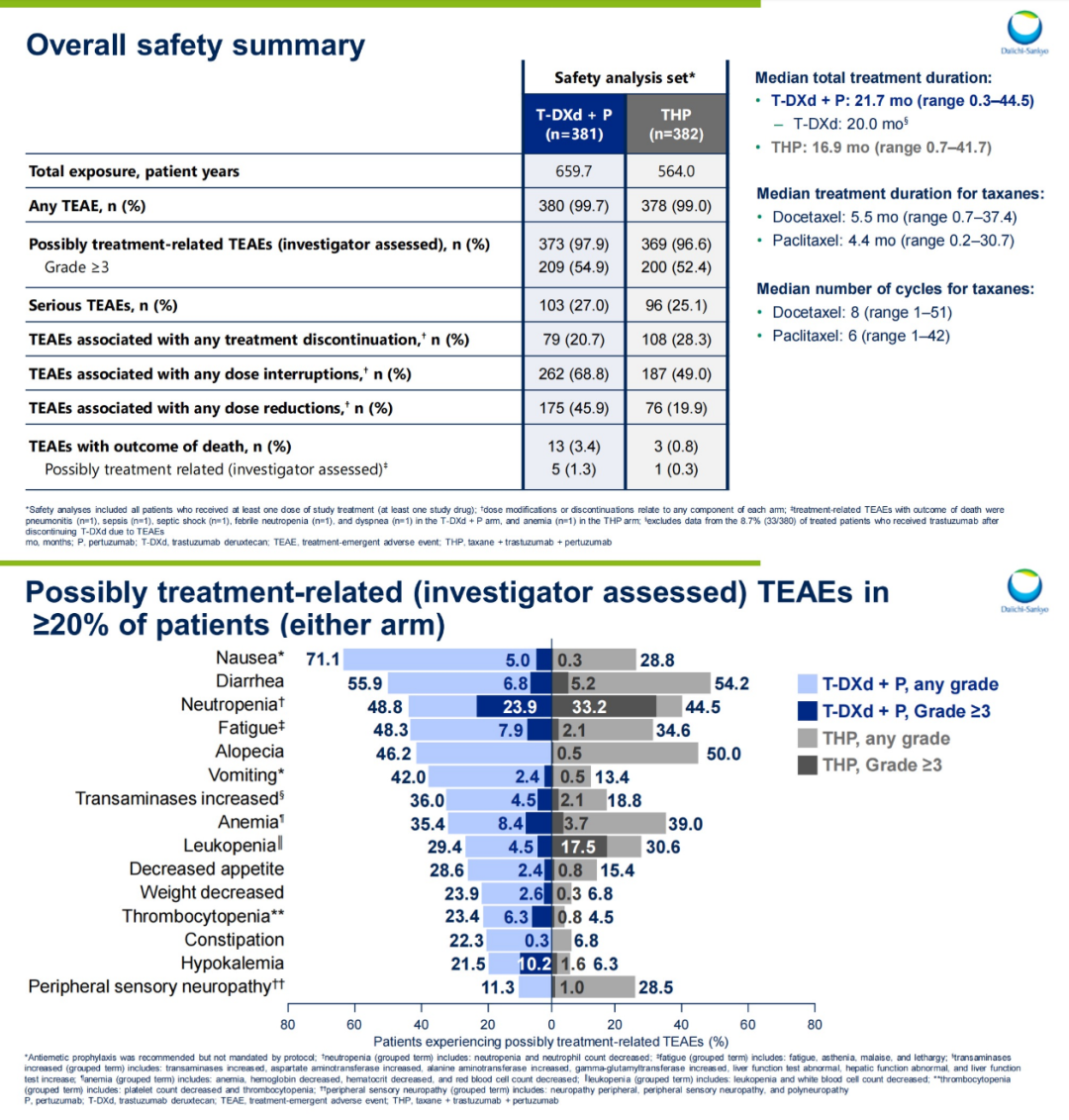
图25. NCT04784715 安全性特征
同时入选LBA的还有另一项来自荣昌生物的研究,评估了Disitamab vedotin(RC48)联合特瑞普利单抗及化疗或曲妥珠单抗方案,用于HER2表达局部晚期或转移性胃癌的一线治疗(NCT05980481)。此前,RC48仅获批用于二线及以后治疗,此次研究也标志着RC48首次将治疗线数前移至一线。
主要入排标准:组织学或细胞学确认的不可切除局部晚期/转移性胃/胃食管结合部腺癌;未接受过针对该癌症的全身性化疗;HER2过表达队列:IHC 3+ 或 IHC 2+/FISH+;HER2中/低表达队列:IHC 2+/FISH-(中表达)或 IHC 1+(低表达)
给药方案和分组:
HER2高表达患者随机分为3组:
试验组1:RC48(2.5 mg/kg)+特瑞普利单抗+CAPOX化疗(奥沙利铂 130 mg/m2+卡培他滨 1000 mg/m2)
试验组2:RC48(2.5 mg/kg)+特瑞普利单抗+曲妥珠单抗(无化疗方案)
对照组:特瑞普利单抗+曲妥珠单抗+CAPOX化疗
HER2中、低表达患者:
阶段1——患者按1:1随机分为两组:
试验组1:RC48(2.5 mg/kg)+特瑞普利单抗+CAPOX化疗
对照组1:特瑞普利单抗+CAPOX化疗
阶段2(剂量优化)——基于阶段1安全性数据,患者按1:1:1随机分为三组:
试验组2:RC48(2.5 mg/kg)+特瑞普利单抗 + CAPOX化疗(奥沙利铂 100 mg/m2+卡培他滨 750 mg/m2)
试验组3:RC48(2.0 mg/kg)+特瑞普利单抗+CAPOX化疗(奥沙利铂 100 mg/m2+卡培他滨 750 mg/m2)
对照组2:特瑞普利单抗+CAPOX化疗
主要终点:ORR
入组人数:144
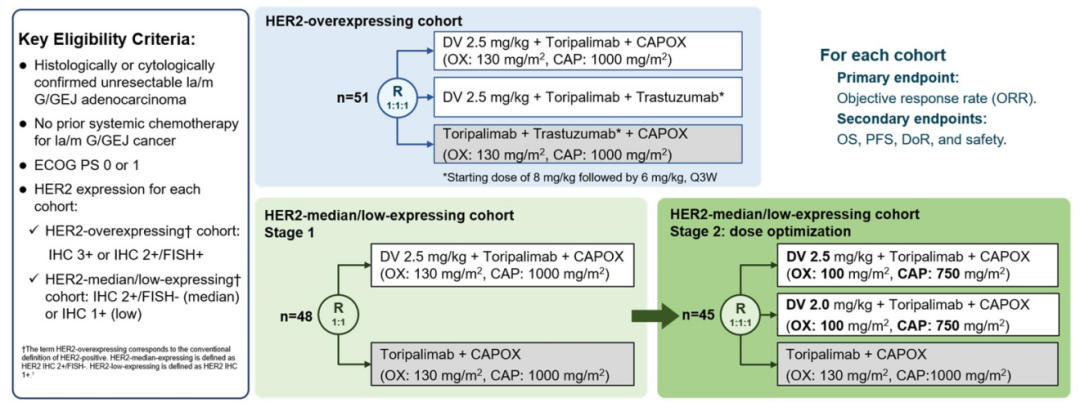
图26. NCT05980481 临床试验设计[8]
临床试验结果
疗效数据:
HER2高表达患者:试验组2的ORR达82.4%,为既往胃癌一线治疗单一药物联合免疫治疗和靶向治疗最优;中位随访时间13.2个月
HER2低表达患者:
阶段1:试验组1 ORR为70.8%;与对照组1相比,中位PFS分别为9.9个月 vs 7.2个月(HR=0.69),提示试验组明显获益
阶段2:试验组2 ORR达76.9%
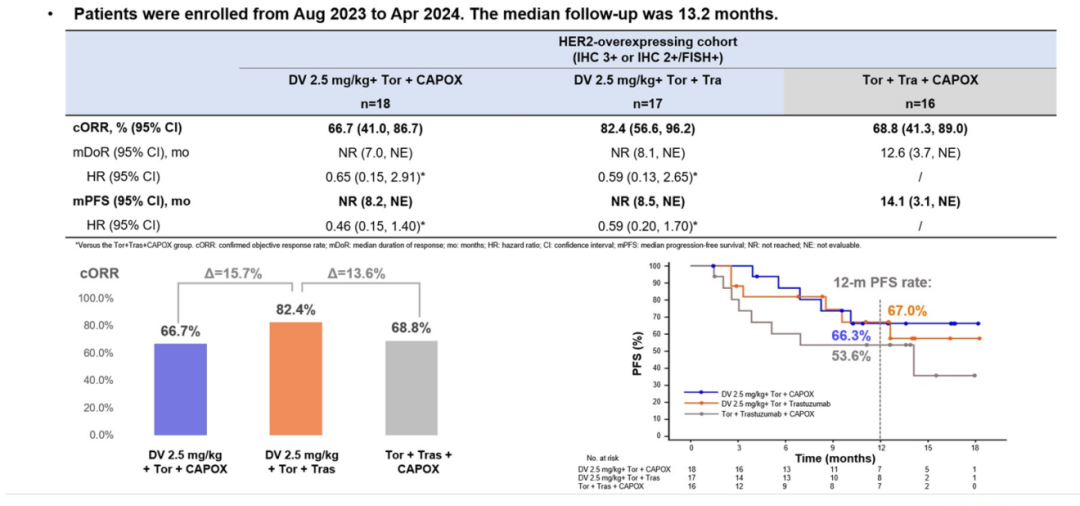
图27. NCT05980481 HER2高表达患者疗效数据
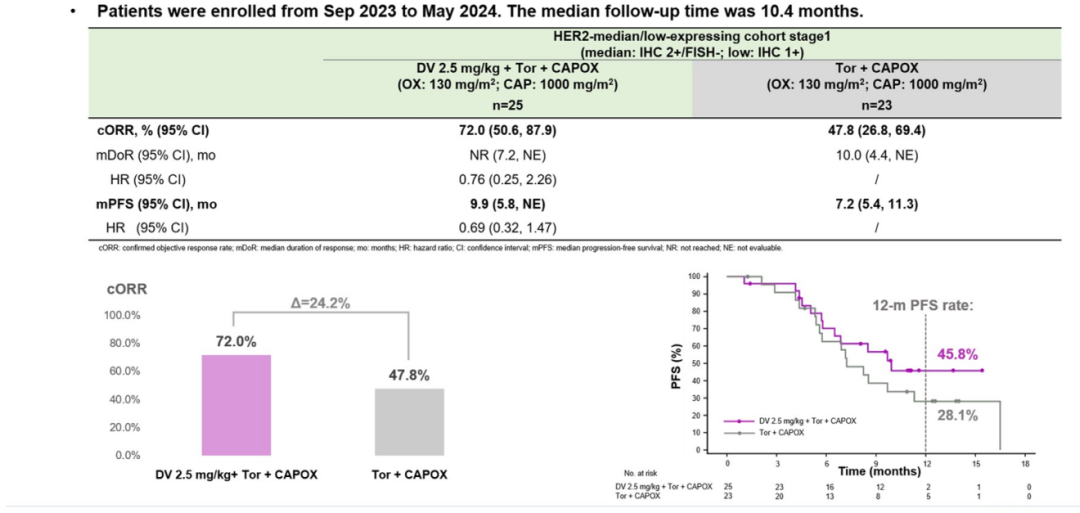
图28. NCT05980481 HER2中/低表达患者第一阶段疗效数据

图29. NCT05980481 HER2中/低表达患者第二阶段疗效数据
4.2
新辅助疗法治疗的尝试
在实体肿瘤治疗领域,新辅助(Neoadjuvant)作为一种术前系统性治疗方案,在改善手术切除率及患者生存结局方面发挥着关键作用。近年来,随着ADC药物的快速发展和在后线治疗中逐步取得突破,正逐步优化和革新传统化疗方案的应用模式,推动新辅助治疗向“降阶减毒”的精准化和个体化方向发展。
2025 ASCO年会更是进一步见证了ADC在新辅助疗法治疗领域的突破性尝试,其中以正大天晴的HER2双抗ADC TQB2102为代表,在针对HER2阳性乳腺癌的新辅助治疗II期试验(NCT06198751)中展现了令人期待的治疗潜在[9]。本文对该临床研究进行解读,期待能够为该领域的更多研究进展提供参考。
主要入排标准:HER2阳性II-III期乳腺癌患者
给药方案和分组:
第一阶段:6 mg/kg组,平行设置两个治疗周期亚组(6周期;8周期)
第二阶段:7.5 mg/kg组,平行设置两个亚组(6周期;8周期)
每个亚组各26人
主要终点:病理完全缓解(pCR)
入组人数:104
临床试验结果
疗效数据:
8周期治疗组——整体tpCR率:73.1%
6.0 mg/kg队列:76.9%
7.5 mg/kg队列:69.2%
6周期治疗组——整体tpCR率:59.6%
6.0 mg/kg队列:57.7%
7.5 mg/kg队列:61.5%
安全性数据:≥3级TRAE发生率为27.9%,间质性肺炎发生率0.96%
4.3
生物标志物驱动的疗效预测研究
除具体ADC药物的临床进展外,2025 ASCO年会还呈现了多项围绕生物标志物驱动的疗效预测研究结果,系统性整合了与耐药相关的基因组变异、指标靶点表达特征和多组学数据等关键因素。值得关注的是,这些研究中,部分研究聚焦于液体活检(Liquid biopsy)技术在评估临床疗效中转化应用探索的价值。基于此,我们对本届大会的此类研究进行了汇总,从中精选了两项聚焦转移性乳腺癌的多药对比研究进行解析。
图31. 生物标志物驱动的疗效预测研究
I.转移性乳腺癌中ADC治疗响应的转录组学生物标志物:一项综合性多中心研究[10]
该研究通过对接受DS-8201(T-DXd)、PRO-132365(T-DM1)和IMMU-132(SG)治疗的转移性乳腺癌患者(n=453)治疗前的转录组数据的分析,发现药物外排转运体ABCB1和ABCC1在ADC药物治疗响应中的潜在相关性。
T-DXd组:ABCB1和ABCC1高表达与治疗持续时间缩短(r=-0.290, p=0.017;r=-0.274, p=0.025)相关,且ABCB1高表达患者死亡风险增加30%(HR=1.30, p=0.002)
SG组:ABCC1和ABCC4高表达患者OS较差(HR=1.34, p=0.034;HR=1.19, p=0.042)
T-DM1组:未发现显著关联
以上研究提示,药物外排转运体,如ABCB1,可作为T-DXd耐药的预测标志物及联合治疗靶点。
II.转移性乳腺癌中与德曲妥珠单抗(T-DXd)、曲妥珠单抗-美坦新偶联物(T-DM1)及戈沙妥珠单抗(SG)持续获益时间相关的基因组变异[11]
Genomic alterations (GAs) associated with durability of benefit from trastuzumab deruxtecan (T-DXd), trastuzumab emtansine (T-DM1) and sacituzumab govitecan (SG) in metastatic breast cancer (MBC).
通过对真实世界基因组数据库中1177例接受T-DXd、T-DM1、SG治疗的转移性乳腺癌患者治疗前后的基因组变异(GAs)的分析,发现ERBB2扩增(ERBB2amp)对ADC疗效的普适预测价值:
在HER2阳性患者中:ERBB2amp显著延长了T-DXd和T-DM1的中位下次治疗时间(TTNT),ERBB2amp组患者接受T-DXd的中位TTNT达22.5个月(非扩增组为6.4个月);接受T-DM1的中位TTNT为8.3个月(非扩增组为2.6个月);
在HER2低表达患者中:ERBB2amp同样预示T-DXd疗效更优,截至汇报时间,其TTNT尚未达到(非扩增组中位TTNT为7.4个月)。
本提示,基于全面基因组测序(CGP)的ERBB2amp检测可超越传统的IHC/FISH分型,成为优化T-DXd或T-DM1个体化治疗决策的重要依据。这种精准化的分层策略有助于提高ADC药物的临床获益率。
结语
主流靶点持续深耕,新兴靶点逐渐崛起,已成为全球ADC研发的发展方向。以HER2、Trop2为代表的成熟靶点聚集了全球近半数的ADC管线布局,随着Enhertu、Datropan等重磅ADC相继获批,该领域竞争格局已经相对饱和,且提高了“最佳标准治疗”的监管标准。在此背景下,后来者唯有在疗效或安全性方面建立突破性优势,才有可能赢得生存空间。然而,即使疗效胜出,后来者往往也较难撼动先行者已建立的商业生态。当“me-better”无法转化为“market-better”,后来者容易陷入“烧钱追赶却难破壁垒”的困境,也为行业内的创新决策提出了深刻的战略性拷问:“Go or No Go?”。
在此背景下,全球ADC管线布局正在发生结构性调整:一方面,企业在主流靶点中寻求差异化突破,如通过优化连接子-毒素改良、抗体工程化改造等技术手段提升现有产品的临床获益;另一方面,新兴靶点的挖掘和验证成为新的突破口。从2025年ASCO年会最新趋势来看,一些全新靶点已获得初步的积极数据,展现出独特的治疗潜力。由于新兴靶点领域的高不确定性,研发企业在新兴靶点领域进行临床开发的容错率极低。这意味着研发团队需要具备更高的技术门槛和精准的研发策略,尤其是在靶点选择、分子设计、临床试验规划以及对外合作(BD)等方面。因此,在这一领域进行创新的企业不仅需要深厚的技术积累,还需在跨学科协作、非临床研究、转化医学和临床开发方面具备更强的综合实力,而通过BD实现资源整合与研发策略升级更是不容忽视的关键路径。
值得注意的是,在ADC的研发中,“联用策略”正逐渐成为另一个重要突破方向。ASCO 2025年会数据显示,ADC与IO的“强强联合”模式已取得初步的显著成果,这种模式不仅拓展了传统治疗方法的边界,也为未来探索更高效的抗肿瘤策略提供了重要参考。此外,基于特定生物标志物驱动的个体化治疗有望为个性化精准治疗策略提供科学依据。上述创新性组合治疗模式的成功,也将进一步推动ADC药物在临床应用中的价值提升,并为癌症患者带来新的治疗希望。
供稿:转化科学与药政策略部
参考文献
[1]Becotatug vedotin vs. chemotherapy in pre-heavily treated advanced nasopharyngeal carcinoma: A randomized, controlled, multicenter, open-label study. 2025. ASCO.
[2]http://www.baili-pharm.com/about.aspx?mid=110&sid=
[3]Phase I study of iza-bren (BL-B01D1), an EGFR x HER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic non-small cell lung cancer (NSCLC) with driver genomic alterations (GA) outside of classic EGFR mutations. 2025. ASCO
[4]Phase I study of iza-bren (BL-B01D1), an EGFR x HER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic small cell lung cancer (SCLC). 2025. ASCO
[5]Rinatabart sesutecan (Rina-S) for patients with advanced endometrial cancer: First disclosure from dose expansion cohort B2 of the GTC1184-01 study. 2025. ASCO
[6]Su MC, Yuan RH, Lin CY, Jeng YM. Cadherin-17 is a useful diagnostic marker for adenocarcinomas of the digestive system. Mod Pathol. 2008;21(11):1379-1386.
[7]Trastuzumab deruxtecan (T-DXd) + pertuzumab (P) vs taxane + trastuzumab +pertuzumab (THP) for first-line (1L) treatment of patients (pts) with human epidermal growth factor receptor 2–positive (HER2+) advanced/metastatic breast cancer (a/mBC): Interim results from DESTINY-Breast09. 2025. ASCO
[8]Disitamab vedotin (DV) plus toripalimab (Tor) and chemotherapy (C)/trastuzumab (Tra) as first-line (1L) treatment of patients (pts) with HER2-expressing locally advanced or metastatic (la/m) gastric cancer. 2025. ASCO
[9]Efficacy and safety of neoadjuvant TQB2102 in women with locally advanced or early HER2-positive breast cancer: A randomized, open-label, multi-centre phase 2 trial. 2025. ASCO
[10]Transcriptomic biomarkers of therapeutic response to antibody-drug conjugates in metastatic breast cancer: A comprehensive multi-center study. 2025. ASCO
[11]Genomic alterations (GAs) associated with durability of benefit from trastuzumab deruxtecan (T-DXd), trastuzumab emtansine (T-DM1) and sacituzumab govitecan (SG) in metastatic breast cancer (MBC). 2025. ASCO


































































































































