


上期文章,鼎泰集团先后对临床试验失败的5款 siRNA 药物及失败原因(点击查看原文)、已上市的6款 siRNA 药物的非临床药效学内容(点击查看原文)、 siRNA 药物非临床研究价值的延伸 —— 杂质控制(点击查看原文)进行了复盘分析,受到了同行的广泛关注。在以临床价值为导向的新药立项、研发、审评、审批趋势下,一个有潜力的 siRNA 候选药物的成功开发离不开对临床研究计划的精心设计和规划。
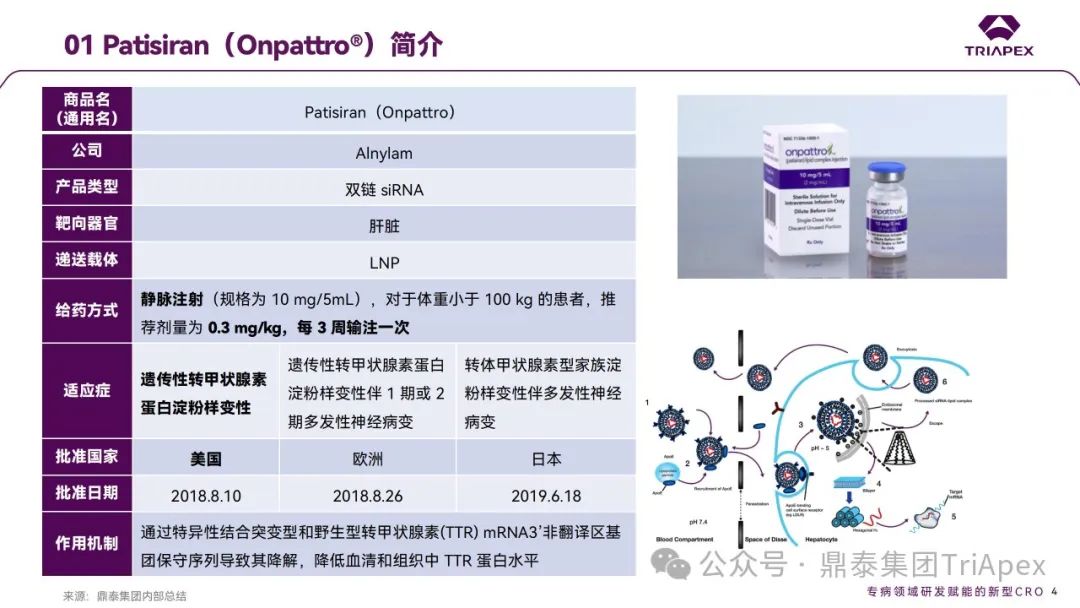
2018年第一款 siRNA 药物 Patisiran(Onpattro®)获得 FDA 批准上市,这对于“沉默”了多年的 siRNA 药物来说无疑是一个振奋人心的好消息。截至目前,已有6款 siRNA 药物获得了FDA批准上市。基于我们之前的总结,鼎泰团队继续对siRNA药物非临床研究后的下一关键环节 —— 临床开发路径进行了系统的梳理和复盘。本期内容将重点对第1款已上市 siRNA 药物—— Patisiran 的上市历程及临床开发路径进行分享,以期为siRNA药物全局视角的研发提供参考和启发。
Patisiran 的上市历程
Patisiran是一种以脂质纳米颗粒(LNP)为递送系统的小干扰RNA(siRNA)药物,通过靶向并沉默转甲状腺素蛋白(TTR)的mRNA,抑制野生型和突变TTR蛋白的表达,有助于清除外周组织中TTR蛋白沉积并恢复这些组织的功能。
2018年8月10日,Patisiran获FDA批准上市,用于治疗成人遗传性TTR淀粉样变性多发性神经病(ATTR-PN),这是全球首款获得FDA批准的RNAi疗法;
2018年8月26日和2019年6月18日,分别获EMA和PMDA批准上市。该产品由Alnylam Pharmaceuticals负责销售,商品名为Onpattro®。
Onpattro® 的获批是siRNA疗法的重要里程碑,实现了人体内siRNA疗法的靶向递送,也为ATTR-PN的治疗提供了新方案。目前,本品还获批用于治疗遗传性转甲状腺素蛋白淀粉样变性伴1期或2期多发性神经病变、转甲状腺素型家族淀粉样变性伴多发性神经病变。
转甲状腺素蛋白淀粉样变性多发性神经病
转甲状腺素蛋白淀粉样变性多发性神经病(transthyretin amyloid polyneuropathy,ATTR‑PN),又称转甲状腺素蛋白相关家族性淀粉样变性多发性神经病(transthyretin familial amyloid polyneuropathy,TTR‑FAP),是一种由编码转甲状腺素蛋白的TTR基因变异导致的罕见的常染色体显性遗传性、以周围神经损害为主的多系统疾病。该病的发病机制是TTR蛋白错误折叠,最终形成淀粉样物质沉积在组织中。
据估计,全世界的患病人数为 5000~10000 人,不同国家的发病率存在差异。近年来,我国对 ATTR‑PN 也有较多报道。ATTR‑PN 以周围神经损害为主,同时累及多个系统,病情进展缓慢。从出现症状开始,患者平均生存时间一般为6~12年。ATTR‑PN 的起病年龄跨度很大,我国人群的起病年龄在 17~68 岁,平均患病年龄 42 岁。以起病年龄 50 岁为界,分为早发型和晚发型。多数患者具有常染色体显性遗传家族史。由于淀粉样物质可以在全身多个器官沉积,患者可出现神经系统、心脏、眼、肾脏等多系统受累的临床表现,不同患者各系统损害程度存在较大差异。
1
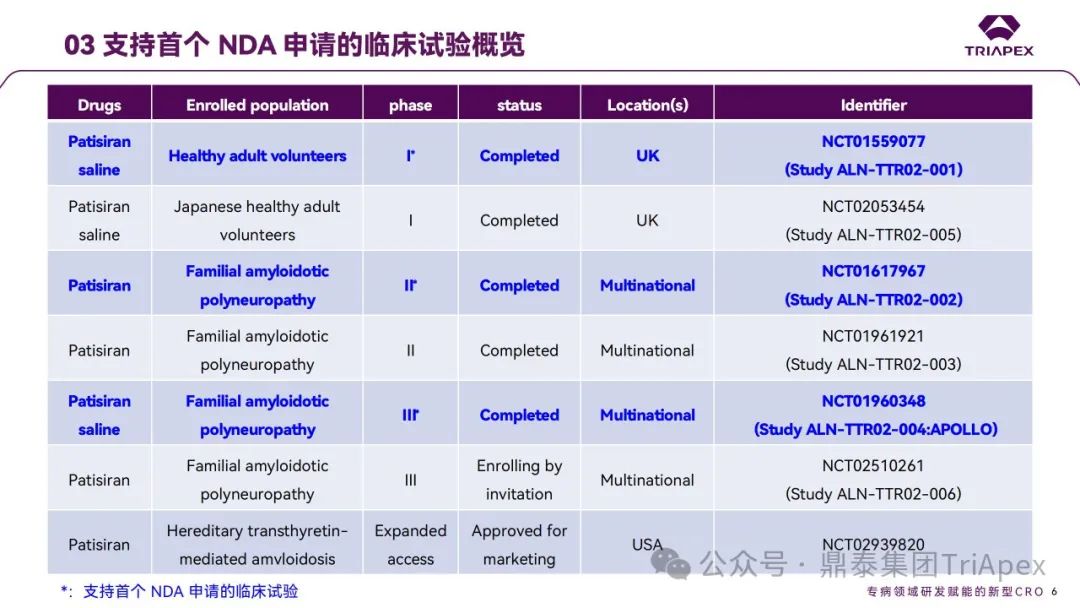
Ⅰ 期临床试验(NCT01559077)
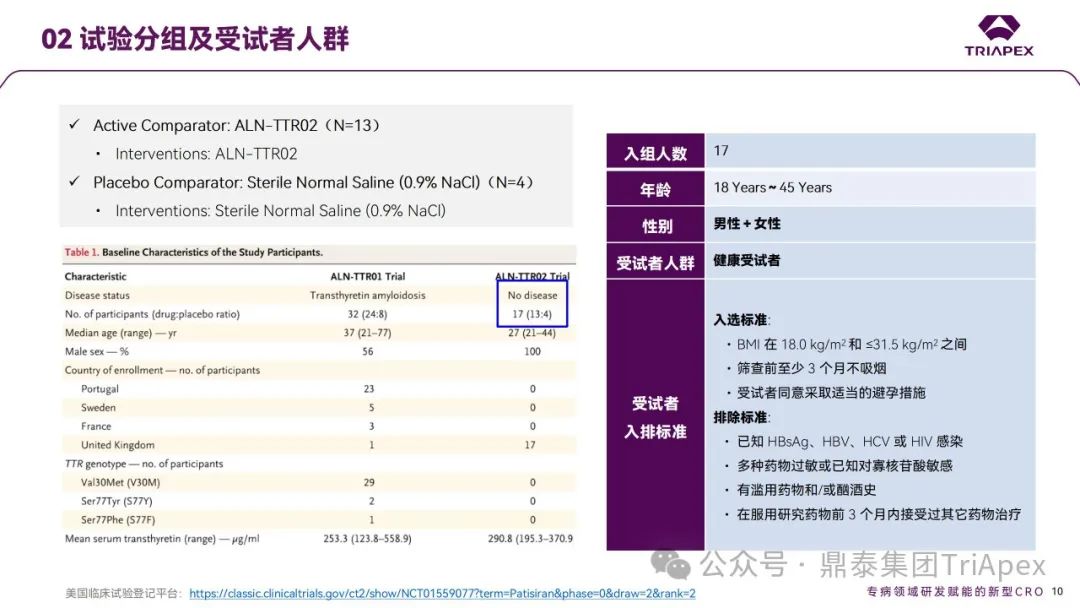
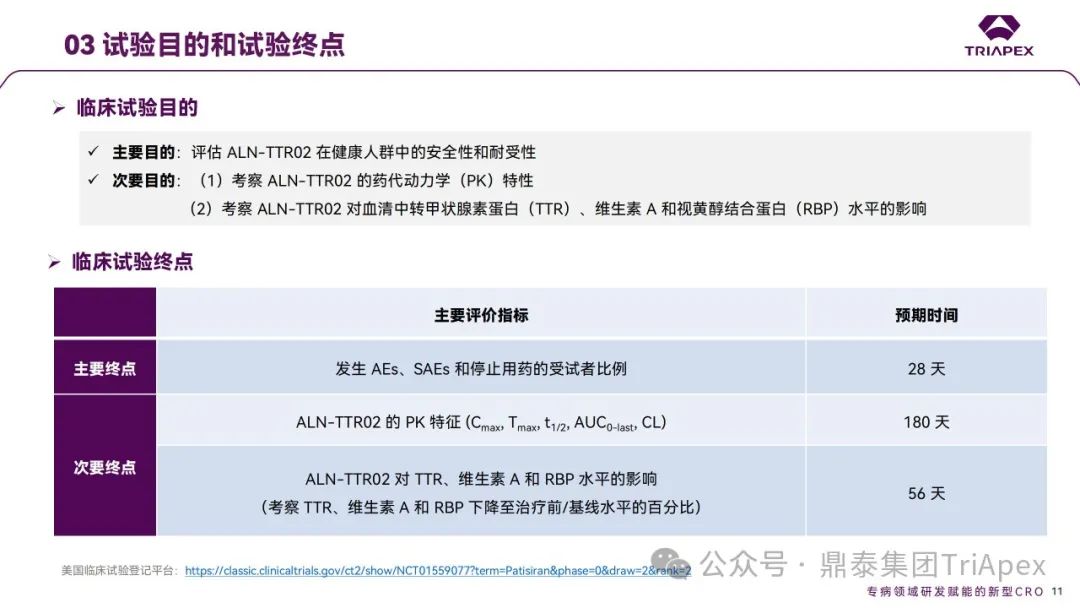
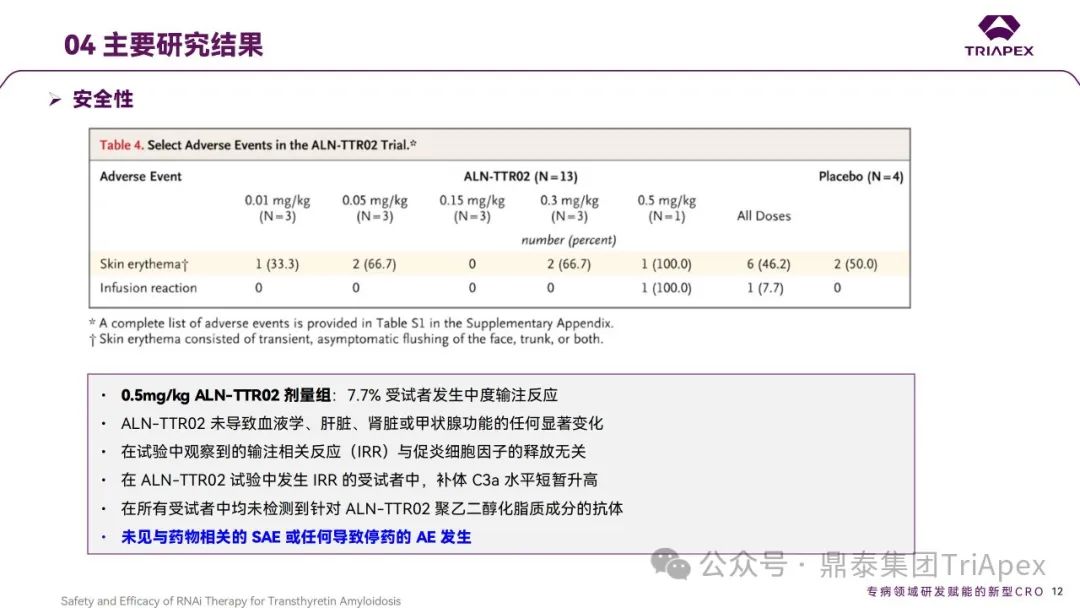
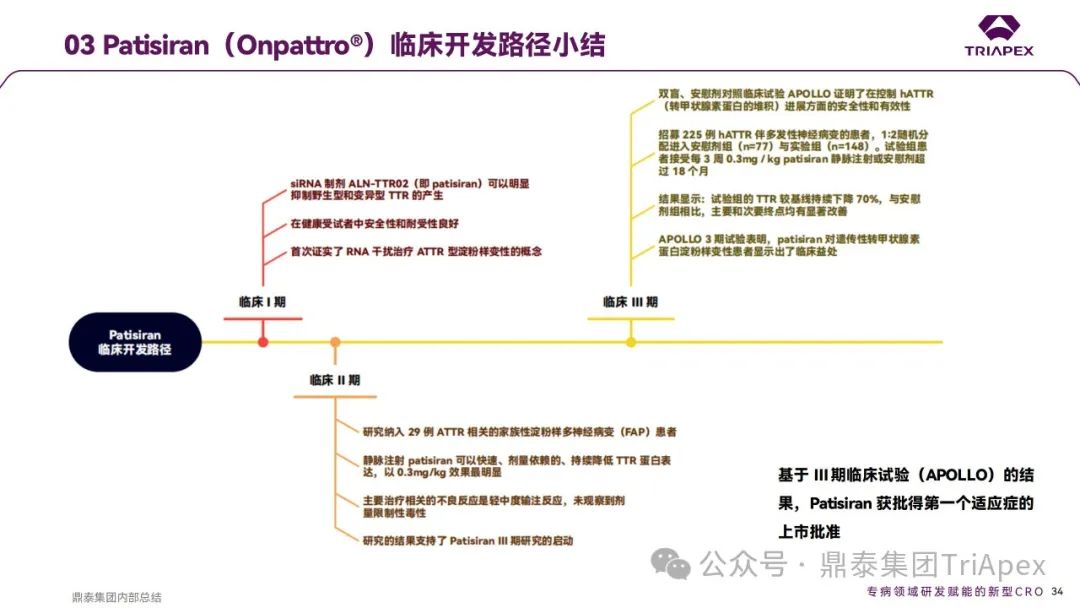
2012 年,Patisiran 的首次人体试验(FIH)在英国开展。这是 1 项多中心、随机、单盲、安慰剂对照、剂量递增试验,旨在评估单剂量 Patisiran (代号ALN-TTR02)在健康成年受试者中的安全性和耐受性。17 名受试者(每组 4 名)以3:1 比例随机分配接受 Patisiran(0.01、0.05、0.15、0.3和0.5 mg/kg)或安慰剂(生理盐水)。为降低输注反应,受试者在输注当天接受术前用药(包括地塞米松、对乙酰氨基酚、苯海拉明、西替利嗪、雷尼替丁等)。主要终点为给药后第 28 天时发生 AEs、SAEs 和中断用药的受试者比例;次要终点为血浆药代动力学(PK)参数和对血清中 TTR、维生素A和视黄醇结合蛋白(RBP)水平的影响。
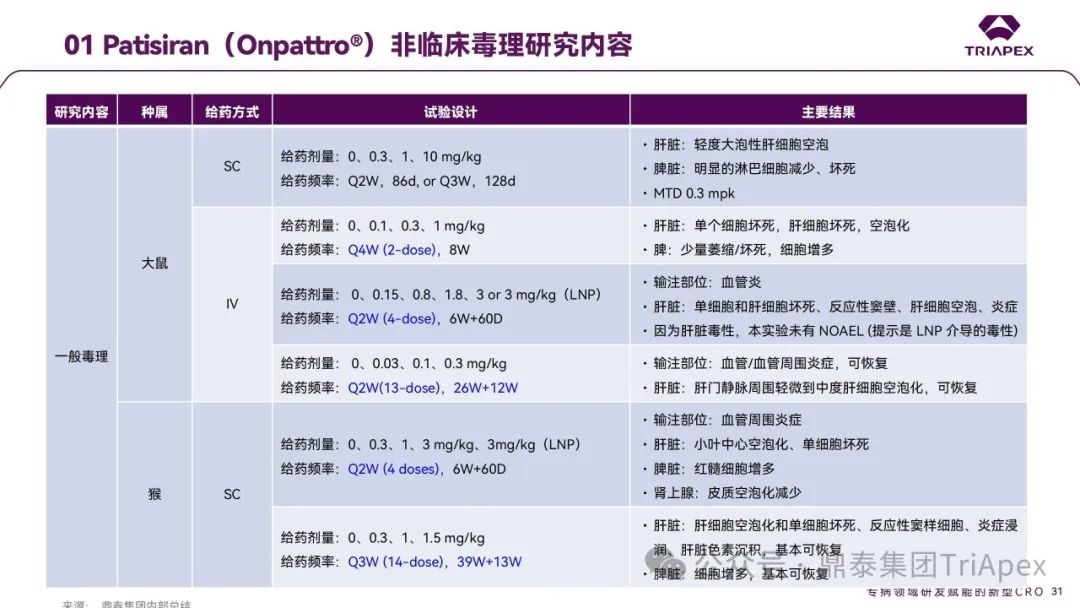
本研究中起始剂量和最大递增剂量主要依据临床前毒理学数据:根据大鼠和猴毒理学数据并预留了足够的安全系数,FIH 起始剂量定为 10 μg/kg;基于猴毒理学数据和安全系数,拟定最高剂量为 500 μg/kg。
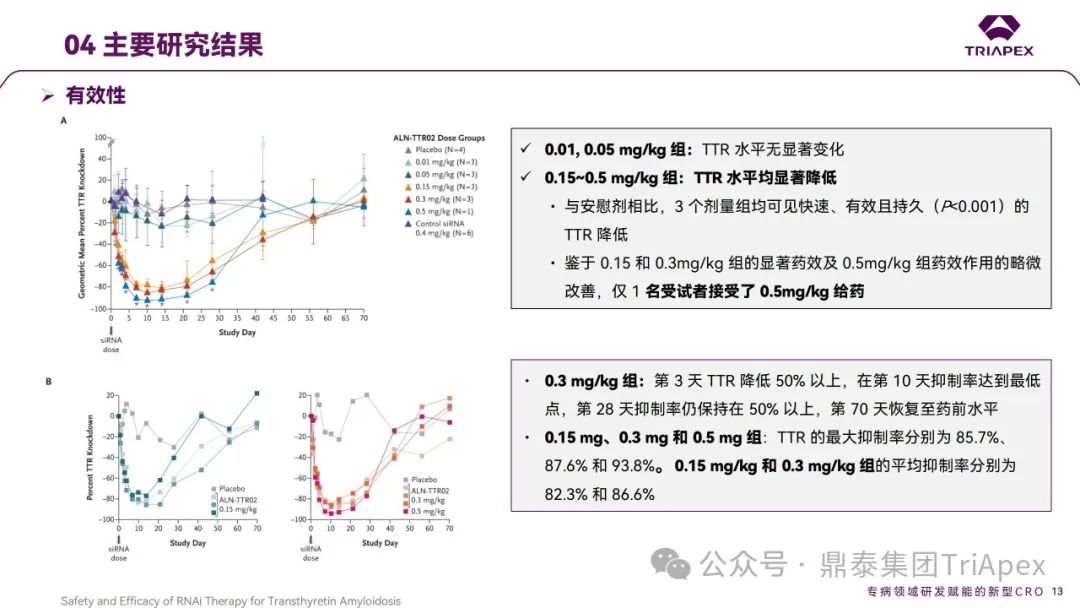
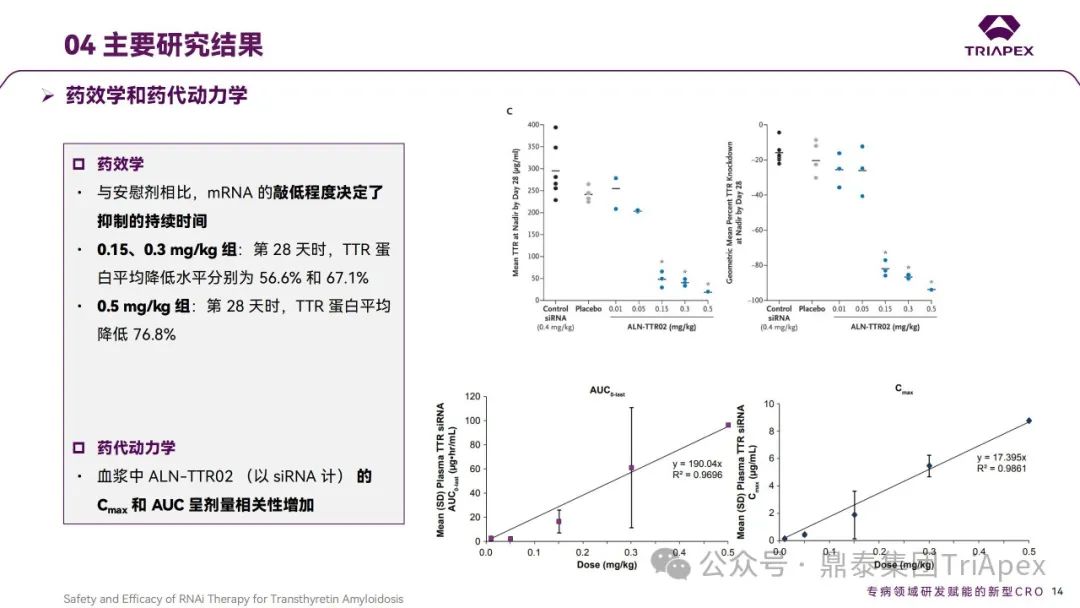
结果显示,Patisiran 可剂量依赖性显著降低野生型和突变型 TTR 蛋白的表达水平,至 28 天时仍能表现出对上述生物标志物的抑制;安全性和耐受性良好。
本研究首次对将 siRNA用于治疗 ATTR-PN进行了概念验证[1],为Patisiran和后续基于GalNac递送系统的Vutrisiran的开发奠定了信心。
2
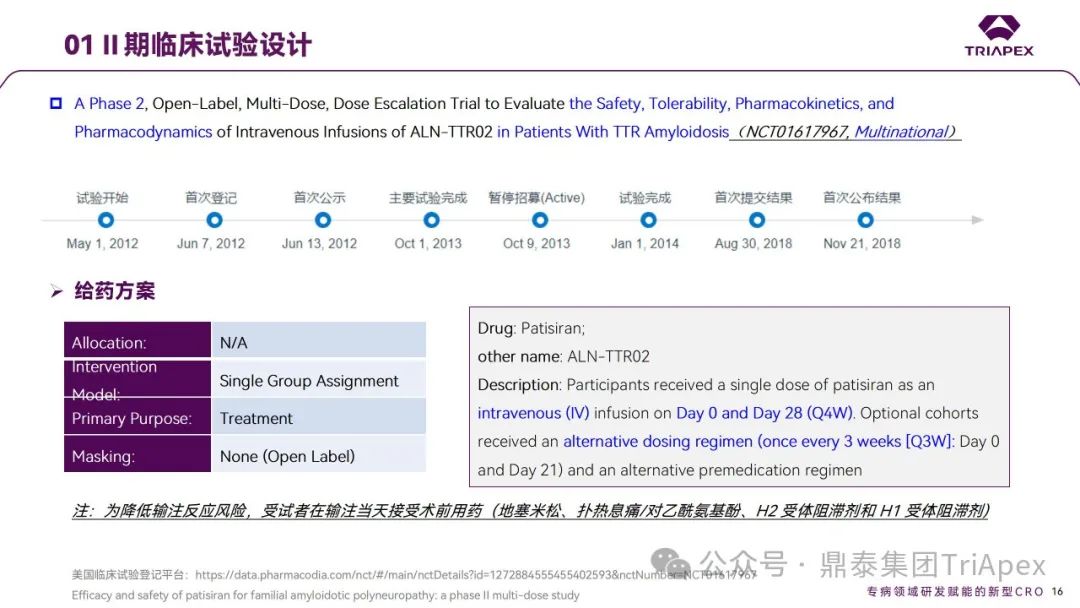
Ⅱ 期临床试验(NCT01617967)
Ⅱ 期临床试验(国际多中心)共纳入 29 例 ATTR‑PN 患者,其中26例患者完成了研究。患者分为9个队列,队列1-3接受2剂0.01、0.05和0.15mg/kg Patisiran(Q4W),队列4和5接受2剂0.3mg/kg Patisiran (Q4W),队列6-9接受2剂 0.3 mg/kg Patisiran(Q3W),给药方式均为静脉注射。主要终点为给药第56天时,发生 AEs、SAEs 和停止用药的受试者比例;次要终点包括给药后相比基线 TTR 蛋白的百分比变化、给药后第21/28天时的 PK 参数。
在本项 Ⅱ 期临床试验中,起始剂量和最高剂量根据非临床毒理学结果推导获得,并基于已获得的健康人 Ⅰ 期临床试验(NCT01559077)的安全性和耐受性结果进行确认。
结果显示,静脉注射 Patisiran 可以快速、剂量依赖地持续降低ATTR‑PN患者血清中 TTR 蛋白表达水平。其中,以 0.3mg/kg 效果最明显,对野生型和突变型 TTR 的效果类似;以Q3W给药2次后 TTR 平均降低超过 85%,最大超过96%。安全性和耐受性良好,大多数AE的严重程度为轻度或中度,主要治疗相关的AE是轻中度注射部位反应[2],未观察到剂量限制性毒性。
基于该 II 期临床试验结果,Alnylam 于2013 年 9 月 23 日申请召开 EOP2 会议,就 CMC和非临床研究的充分性以及拟开展的 Ⅲ 期临床试验方案的设计征求 FDA 的建议。也是基于该研究支持了 Patisiran Ⅲ 期临床试验的启动。
3
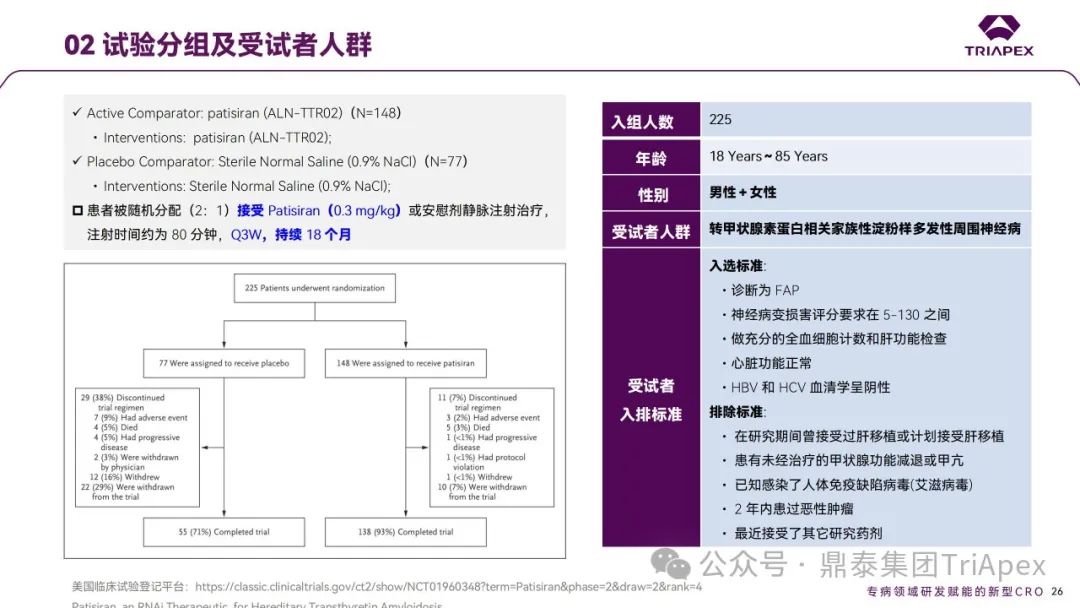
Ⅲ 期临床试验(NCT01960348,代号APOLLO)
随后的 Ⅲ 期随机双盲、安慰剂对照的国际多中心临床试验证明了 Patisiran在控制 ATTR‑PN 进展方面的安全性和有效性。该试验在 19 个国家,44 个中心共招募了 225 例ATTR‑PN患者,以2:1随机分配进入试验组(n=148)或安慰剂组(n=77),分别接受 0.3 mg / kg Patisiran 或安慰剂治疗,静脉注射,Q3W。两组受试者在输注当天均接受术前用药以减轻输液反应。主要终点为给药第18个月时改良神经病变损伤评分+7(mNIS+7)相比基线的变化;次要终点包括诺福克生活质量-糖尿病神经病变 (Norfolk QoL-DN) 问卷等。
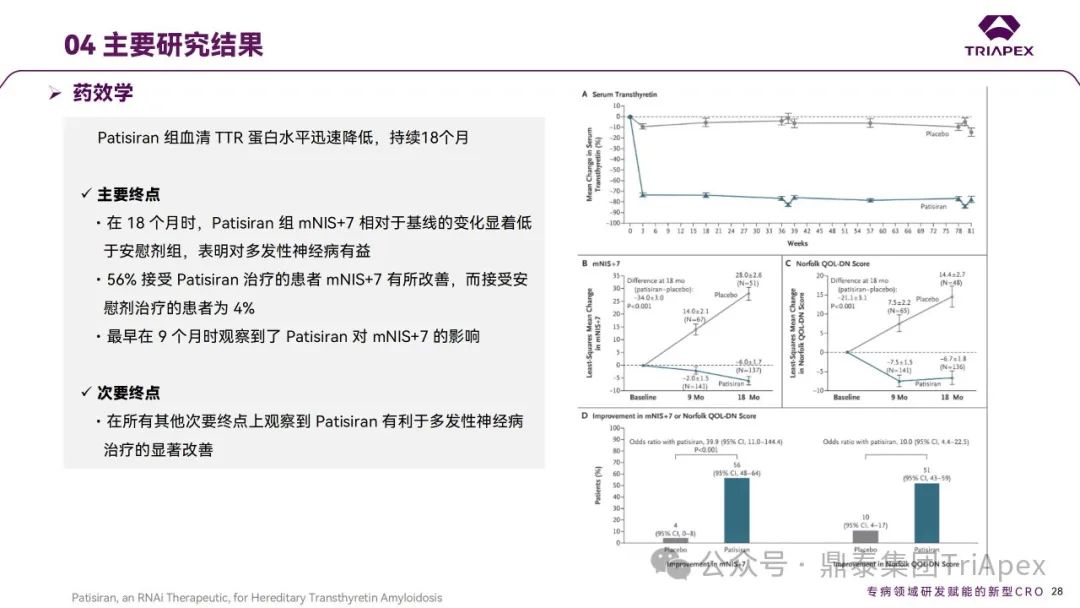
在该项 Ⅲ 期临床试验中,Patisiran达到了所有的主要和次要终点,对hATTR 伴多发性神经病变患者显示出了临床获益;主要的安全性发现是轻度至中度输注相关反应,其发生率随时间推移而降低。
主要终点(mNIS+7):给药第 18 个月时,Patisiran组患者的mNIS+7(范围0到304,得分越高,损伤越大)获得显著改善,试验组和安慰剂组发生改善的患者比例分别为 56% 和 4%。
次要终点(Norfold QOL-DN):给药第 18 个月时,51%的Patisiran组患者报告Norfold QOL-DN(范围 -4 到 136,得分越高,生活质量越差)有改善,而安慰剂组只有 10% 改善。试验组心肌病患者(安慰剂组 36 例, Patisiran组 90 例)心脏结构和功能有显著改善。
安全性:试验组最常见的 AEs 是周围水肿和输液相关反应,与安慰剂组相似[3]。
基于上述临床试验结果,Patisiran 获批得 FDA 批准上市,以下是鼎泰团队对 Patisiran 上市历程及临床开发路径的调研。






















参考资料:
[1] Coelho T, Adams D, Silva A, Lozeron P, et al. Safety and efficacy of RNAi therapy for transthyretin amyloidosis. N Engl J Med. 2013 Aug 29;369(9):819-29. doi: 10.1056/NEJMoa1208760. PMID: 23984729.
[2] Suhr OB, Coelho T, Buades J, et al. Efficacy and safety of patisiran for familial amyloidotic polyneuropathy: a phase II multi-dose study. Orphanet J Rare Dis. 2015 Sep 4;10:109. doi: 10.1186/s13023-015-0326-6. PMID: 26338094; PMCID: PMC4559363.
[3] Adams D, Gonzalez-Duarte A, O'Riordan WD, et al. Patisiran, an RNAi Therapeutic, for Hereditary Transthyretin Amyloidosis. N Engl J Med. 2018 Jul 5;379(1):11-21. doi: 10.1056/NEJMoa1716153. PMID: 29972753.


































































































































