


在眼部疾病治疗的征程中,基于腺相关病毒(Adeno-Associated Virus,AAV)的基因治疗已崭露头角,取得了一定的阶段性成果。然而,眼内注射 AAV 后引发的炎症反应常对治疗效果产生不良影响。本研究聚焦于非人灵长类(Non-Human Primates,NHP)及人体眼内注射 AAV 载体药物后的全身与局部免疫反应,深度挖掘相关影响因素,并结合鼎泰眼科中心的丰富项目经验提出解决方案,旨在为眼科 AAV 载体药物的临床应用提供更具深度与前瞻性的见解,推动该领域的进一步发展。
全文共:5798 字 7 图
预计阅读时长:15 分钟
★ 文章导览★
01 | 眼部 AAV 基因治疗优势简述 |
02 | AAV 载体药物免疫反应机制 |
03 | AAV 眼内注射免疫反应及相关因素 |
04 | 鼎泰经验 |
眼部 AAV 基因治疗优势简述
AAV 作为一种无包膜细小病毒,在基因治疗领域占据着重要地位,其应用范围广泛。重组腺相关病毒载体(rAAV)通过基因替代、基因沉默和递送新基因等方式修正遗传病患者的基因缺陷,展现出诸多显著优势。它具有较低的整合风险,能够精准地靶向多种细胞,且免疫原性相对较弱[1]。目前,诸如治疗脊髓性肌萎缩症的 Zolgensma、针对 Leber 先天性黑蒙症 Ⅱ 型的 Luxturna 等多个基于 AAV 的基因治疗药物均已上市,这些成功范例为 AAV 基因治疗的临床应用筑牢了坚实的基础,有力地证明了其巨大的潜力与可行性。
眼睛,在人体生理结构中具有独特的“免疫豁免”特性,这使其成为基因治疗药物的理想作用靶点:
1) 眼睛具有一定程度的“免疫豁免”特权
血-房水屏障和血-视网膜屏障宛如坚固的防线,有效阻挡了血液中的免疫细胞、抗体及其他大分子物质侵入眼内组织,极大地降低了免疫系统对眼内环境的干扰,为 AAV 载体药物的应用营造了相对稳定的环境[2]。
2) 眼部给药在手术操作层面具有较高的可行性
眼部基因治疗药物现阶段主要有视网膜下腔注射和玻璃体腔注射两种注射途径。
视网膜下腔注射能够精准地将药物输送至光感受器细胞与视网膜色素上皮细胞之间,确保药物与视网膜直接接触;
玻璃体腔注射则是将药物注入玻璃体腔内,借助药物在玻璃体液中的自然扩散作用,使其顺利抵达视网膜,实现治疗目的[3]。
3) 眼睛的局部治疗优势显著
由于血-视网膜屏障的存在,药物难以进入全身循环,从而能够在眼内局部形成较高的载体浓度,增强治疗效果。
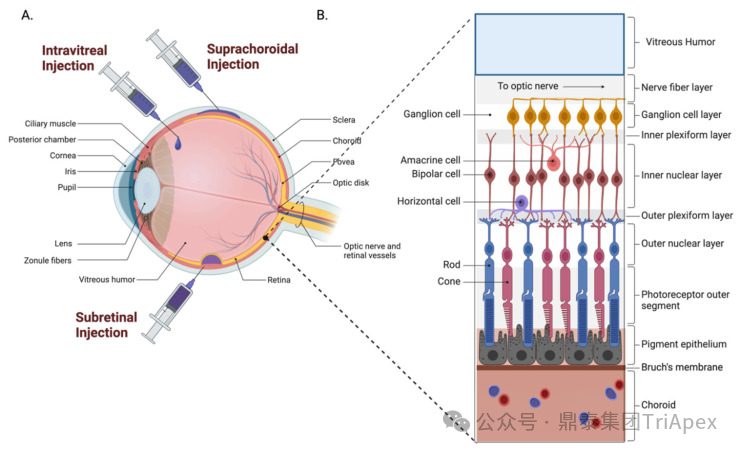
图1. 眼后部解剖结构及给药途径[4]
图1A:玻璃体内注射将药物直接施用于玻璃体,脉络膜上注射直接输送到脉络膜上腔,植入物通常锚定在巩膜上或注射到玻璃体中,视网膜下注射针对视网膜下间隙或视网膜色素上皮细胞和光感受器之间的直接区域;
图1B:眼后部解剖结构由玻璃体和视网膜组成,其中视网膜包含用于光感知的终末分化细胞层。
AAV 载体药物免疫反应机制
| 免疫反应的启动与类型
与天然感染过程类似,当机体免疫系统识别到外来病原体(如 AAV)后,便迅速启动免疫反应,主要分为先天免疫和适应性免疫两大类型。
AAV 病毒核酸和膜糖蛋白会被模式识别受体(PRRs)敏锐捕捉,进而激活核因子 κB(NFκB)和干扰素调节因子(IRF),促使机体合成促炎细胞因子和I型干扰素,引发先天免疫反应
在先天免疫的基础上,抗原呈递细胞(Antigen-Presenting Cells, APCs)将 AAV 抗原呈递给 T 和 B 淋巴细胞,激活这些免疫细胞并促使其产生免疫记忆,引发针对 AAV 的特异性适应性免疫反应,形成了一套严密的免疫防御体系[5]
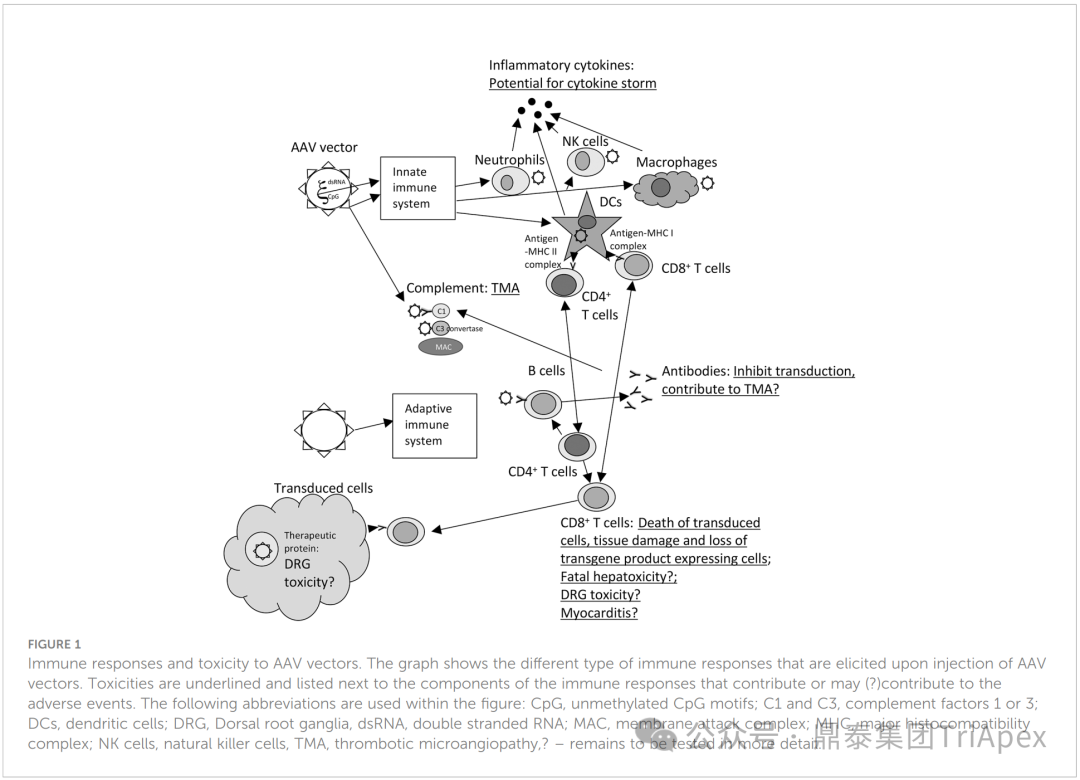
图2. AAV载体的免疫反应和毒性
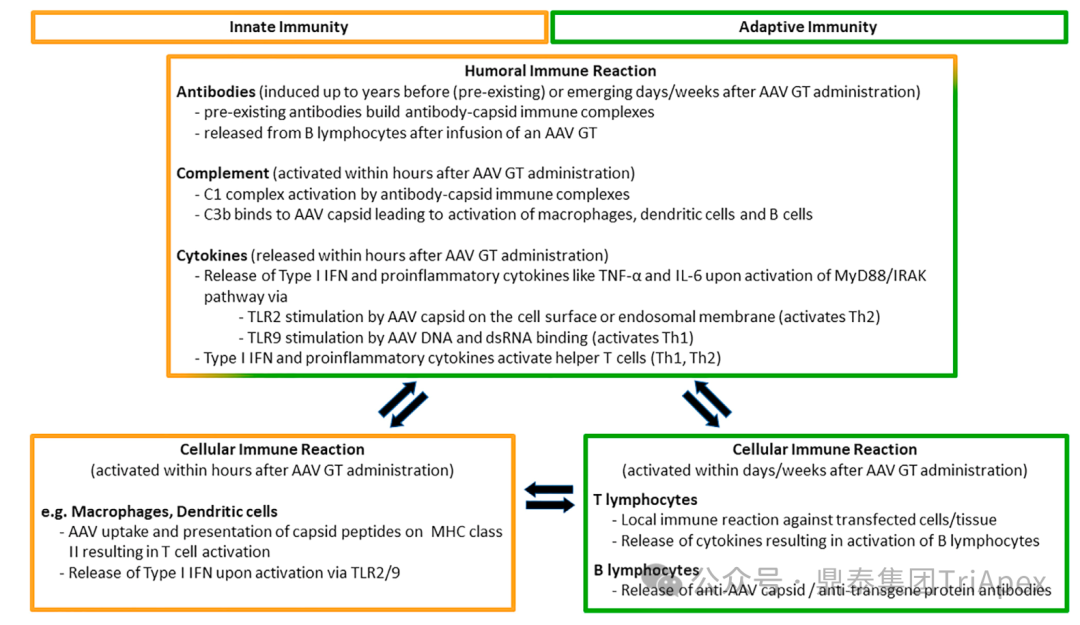
图3. AAV 介导的先天免疫和适应性免疫相互作用
| 细胞免疫机制
细胞免疫涵盖预存免疫和治疗诱导免疫两个方面。
预存细胞免疫可追溯至婴儿期野生型 AAV 感染,过程中产生记忆 T 细胞,但具体作用尚不明确
在治疗诱导的细胞免疫过程中,APCs 发挥着关键的桥梁作用,它将AAV抗原精准地呈递给细胞毒性 CD8+ T 细胞和 CD4+ T 细胞,引发针对 AAV 感染细胞的免疫攻击,这一过程对转基因表达产生重要影响
值得注意的是,在某些特定情况下,细胞免疫反应也可能诱导免疫耐受的产生[6]。
| 体液免疫机制
体液免疫的核心执行者是 B 细胞,其产生的抗体具有中和与结合(非中和)两种功能。
中和抗体(Neutralizing Antibodies, NABs)被定义为能够抑制病毒的传染性或致病机制的抗体
结合抗体(Binding Antibodies, BABs) 或非中和抗体被认为缺乏中和活性,但可能参与免疫细胞的募集和抗体依赖性细胞毒性的诱导[7]
抗体可通过多种机制中和 AAV,如抑制病毒与细胞结合、诱导病毒构象变化、阻止病毒进入细胞或干扰病毒的细胞内过程等。
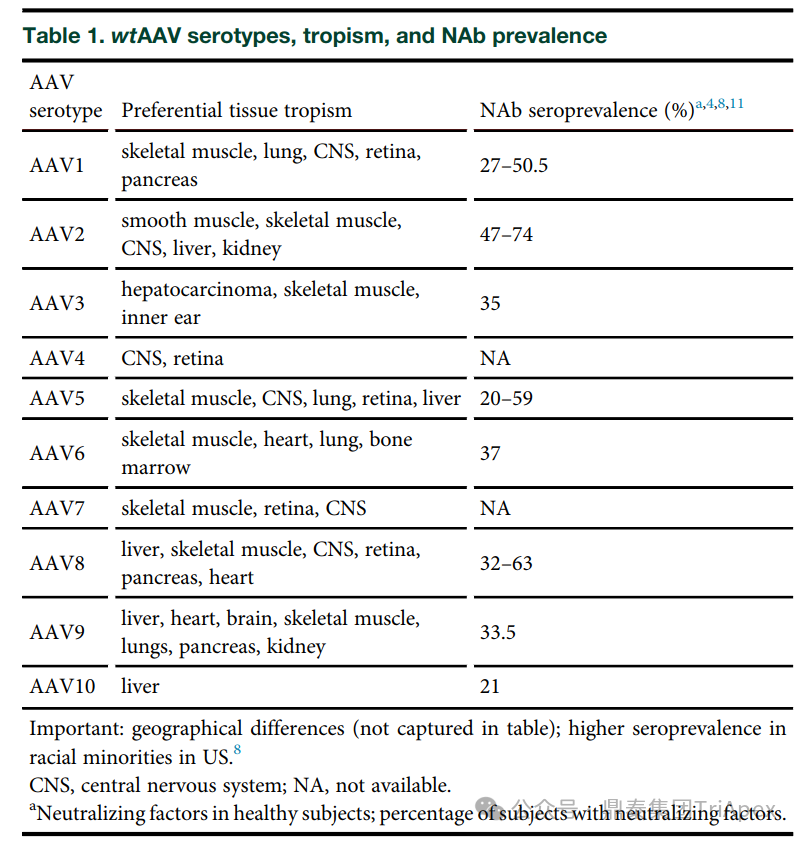
| 眼部免疫特权与免疫反应关系
在 AAV 基因治疗过程中,仍不可避免地会引发体液免疫反应。临床实践中发现,部分患者在接受治疗后出现 NABs 水平升高的现象,且这一现象与眼内炎症、T 细胞反应等因素紧密相关。但目前关于预存 NABs 水平与治疗后 NABs 诱导之间的内在联系,以及中和反应对基因治疗效果和载体再给药的具体影响机制尚不清晰,这也成为了当前该领域研究的重点与难点,亟待科研人员进一步深入挖掘[8]。
使眼睛成为有吸引力的靶组织的一个主要因素是它的相对免疫特权,这归因于血液视网膜屏障的存在。虽然临床研究的初步报告显示了 AAV 的治疗效果、视力改善和良好的安全性,但后续研究显示在临床前研究和临床试验中都有炎症反应,炎症反应可能因多种原因而成为问题,其中之一是免疫机制可能会清除转导细胞,这使免疫特权和 AAV 的低免疫原性都受到质疑[9][10]。
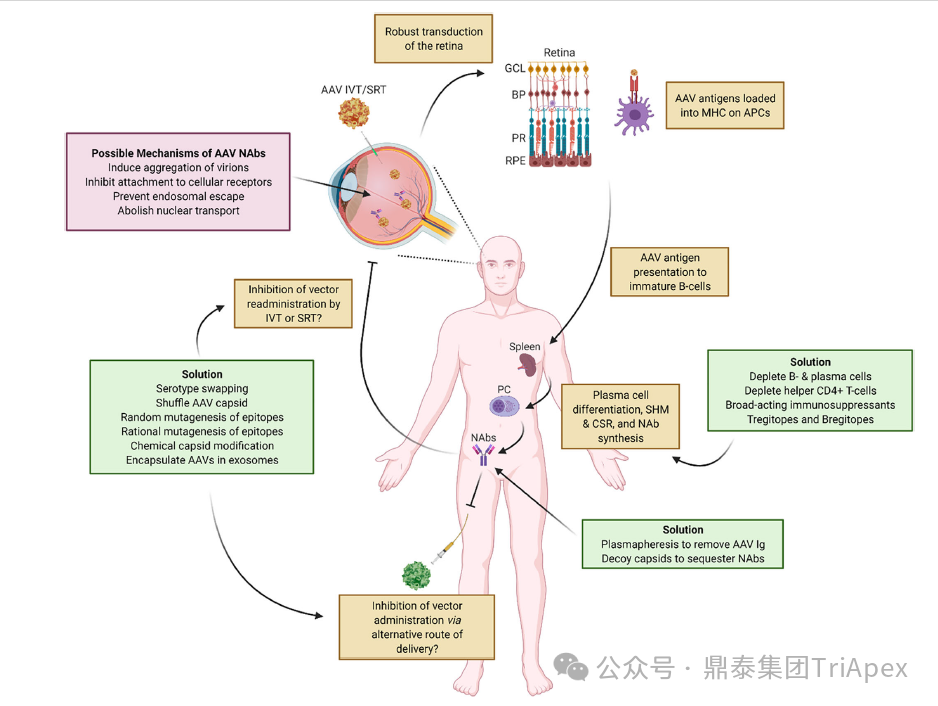
图4. 眼部基因治疗相关的体液免疫反应[8]
AAV 眼内注射免疫反应及相关因素
| 眼局部炎症反应与抗体水平相关性
炎症反应是先天免疫系统应对病原体或受损细胞的一种复杂防御机制。研究表明[9][10],在部分患者中,NABs 水平的显著增加似乎与眼内炎症的发作存在关联,前房及玻璃体等炎症反应常出现在药前与药后数周或数月之间 NABs 滴度变化最大的患者身上。还应注意的是,部分发生眼内炎症的患者药前 NABs 滴度极低甚至检测不到。
Divya 等人的研究发现,向眼内注射高剂量 AAV 药物后,NHP 动物眼部出现沉积物和结构异常[12]。通过对这些动物进行眼局部免疫反应临床分级,分为无炎症组、轻度炎症组和重度炎症组,然后结合血清中结合抗体(BABs)水平进行系统统计分析,得出以下结论:
眼局部炎症反应的严重程度与“血清结合抗体水平”高度相关;与“给药剂量”中度相关;与“启动子类型”弱相关;与“血清型”和“注射方式”无显著相关性
各组动物在注射后 BABs 水平相较于注射前均有显著升高,而无炎症组和重度炎症组间 BABs 水平更是存在显著性差异

图5. 血清 BABs 水平升高与炎症的临床症状相关[11]
图5 A、B:接受高剂量注射的动物和接受中剂量注射的动物的视网膜 OCT 图像,绿线所示为注射日(MO)、注射后1个月(M1)、2个月(M2)、4个月(M4)、5个月(M5),虚线所示为注射区靠近中心凹的视网膜横切面;箭头指向外层视网膜的破裂;
图5 C:眼部免疫反应的临床分级,通过评估注射当天(DO)至注射后 5 个月(5M)的前房细胞、玻璃体细胞、混浊和后葡萄膜炎指标;
图5 D:根据眼部炎症水平分组的 NHPs 药前和药后血清中抗 AAV 结合抗体水平;
图5 E:根据眼部炎症和转基因表达水平分组的 NHPs 血清中抗 AAV 结合抗体水平。
| 注射后抗体水平变化
rAAV 具有同时触发先天免疫反应和适应性免疫反应的能力,且不同血清型在 APCs 细胞转导和 T 细胞激活方面存在明显差异,多种因素相互交织,共同影响着 T 细胞反应的激发过程[13]。
Divya 等人实验结果也表明,向 NHP 注射 AAV2 载体药物后,各剂量组动物血清中 BABs 水平均有所上升,且呈剂量相关性;而 NABs 上升水平似乎与剂量阈值相关,当剂量高于阈值时会引起血清体液反应,反之,低于阈值时则基本不会引起明显反应[12]。
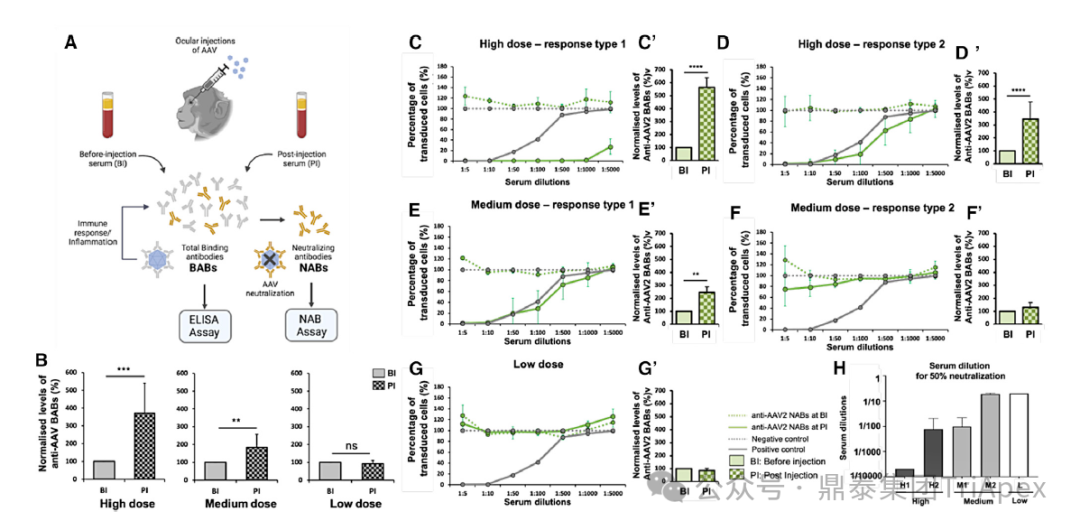
图6. 注射后 BAB 和 NAB 水平呈剂量依赖性增加 [12]
图6A:实验方案示意图,显示注射前(BI)和注射后(PI)的血清收集点;
图6B:高、中、低剂量组 BABs 浓度平均倍数变化;
图6C-G:高、中、低剂量组 NABs 水平变化;
图6C’-G’ :高、中、低剂量组 BABs 水平变化;
图6H:50% AAV 药物被中和的血清稀释度(H1和H2:分别具有高剂量反应类型 1 和 2 的 NHPs;M1 和 M2:分别具有中剂量反应类型 1 和 2 的 NHPs;L为低剂量反应类型的 NHPs)。
| 给药剂量对抗体水平影响
Heier 等人的研究为给药剂量与抗体水平的关系提供了重要线索[11]。在其研究中,低剂量组(2E8-2E9 vg/eye)患者血清中均未检测到 NABs 水平升高;中剂量组(6E9 vg/eye)患者中,2/3 表现出抗 AAV2 NABs 应答;而高剂量组(2E10 vg/eye)患者在长达 1 年的研究期间,NABs 滴度均呈现升高现象。可见在未使用免疫抑制剂的前提下,在上述给药剂量范围内,随着给药剂量的提高,抗体水平也在随之上升。
| 注射方式对抗体水平的影响
视网膜下腔注射和玻璃体腔注射这两种注射方式在免疫反应方面存在着一定差异。视网膜下腔位置相对封闭,免疫细胞分布少;而玻璃体腔内的药物会随着玻璃体液的流动而广泛扩散。因此,相较于视网膜下腔注射,玻璃体腔注射AAV药物似乎更容易与免疫系统发生相互作用。
在 Leber 先天性黑蒙症 Ⅱ 型(LCA2)等疾病的基因治疗临床试验中发现[9],视网膜下腔注射可诱导部分患者产生抗 AAV 体液免疫反应,且不同研究中 NABs 水平的变化情况存在差异。部分患者在接受视网膜下腔注射后,NABs 水平升高并伴有眼内炎症,然而也有部分患者未出现明显的体液免疫反应,且 NABs 水平的升高与 AAV 血清型、剂量及患者个体因素等有关。
与视网膜下腔注射给药相比,玻璃体腔注射给药更易诱导抗 AAV NABs 的产生。在 NHP 研究和临床试验中均发现[14],玻璃体腔注射给药后 NABs 水平显著升高,且具有交叉反应性。不同血清型的 AAV 经玻璃体腔注射后均可诱导 NABs 反应,且部分患者的 NABs 水平在治疗后可长期维持在较高水平。同时眼内炎症与 NABs 水平的升高在部分患者中存在关联性。
| 预存抗体及交叉反应影响
约 70% 的人群体内存在针对常见 AAV 血清型的 NABs,然而预存 NABs 的流行率因血清型和地域而异,且具有高度交叉反应性[12]。Divya 等人通过对 41 只食蟹猴血清中的抗体水平进行统计分析发现,抗 AAV8 抗体水平显著高于其他测试血清型(AAV2、AAV5、AAV9)[12]。
此外,部分血清型间存在交叉反应现象,当注射一种 AAV 血清型,会导致其他血清型的抗体滴度增加,且不同血清型诱导的抗体反应有差异。注射高剂量的病毒更会进一步增强对各血清型的抗体反应,如注射 AAV2 后,预存有抗 AAV9 抗体的动物血清中抗 AAV9 抗体水平显著升高[12][14]。以上结果提示,如使用重复利用动物进行基因治疗产品的相关试验,需明确其给药史。
鼎泰经验
在对眼科基因治疗药物进行非临床研究的长期实践中,鼎泰眼科中心依托丰富的项目实践经验,深入剖析并总结了 AAV 类基因治疗药物在非临床及临床研究中的关键要点,对于免疫原性与眼内炎症的相关性建立了深度的理解,并积累了丰富的关于免疫原性应对方案。
◆ 如何判定眼内炎症与免疫原性的相关性
绝大部分眼内注射都会在不同时期发现各类眼内炎症的表现,所以需要通过证据权重分析其产生原因,鼎泰经验提示可以通过以下几点进行分析:
眼内炎症出现时间及其恢复情况(如注射后数天内可见炎症反应同时很快可以看到恢复,则可能与注射操作相关)
判定是否与供试品相关(剂量-反应关系等)
结合免疫原性检测结果与眼内炎症出现的时间和严重程度综合分析
结合免疫抑制剂使用和眼内炎症恢复情况进行分析……
◆ 在研究中发现, NHP 玻璃体液中 BABs 和 NABs 的阳性率和滴度在观察后期常出现明显升高的现象,同时与给药剂量也呈现正相关。
以某一典型的观察案例为例,给药后4周供试品组动物玻璃体液 BABs 阳性个体比例为 1/12,给药后 13 周阳性个体比例上升至 12/18,抗体滴度也呈现出显著升高的趋势。
◆ 眼内出现明显炎症改变的动物,其血清和/或玻璃体中 BABs 检测结果均为阳性且滴度值处于较高水平;相反,BABs 滴度低的动物眼部则未发现上述改变,同时 NABs 检测结果亦见类似的趋势。
上述文献资料也表明,NHP 血清中 BABs 水平与炎症反应存在一定的相关性[11][14]。此外,通过综合各项眼科检查以及组织病理学分析,发现异常改变的出现时间和发生率与免疫反应的变化趋势高度吻合[15],进一步证实了眼内炎症反应可能是由免疫反应所引起。
◆ 通常情况下,倾向于认为 NHP 对基因治疗产品所产生的免疫原性能够有效地解释毒性结果。然而实际研究过程中,却观察到同一供试品在用于 NHP 时,能够引发明显的免疫原性反应,而部分研究中可见在使用 SD 大鼠进行试验时,却并未出现类似的反应。
这一鲜明的对比充分表明,免疫反应在不同种属之间存在着显著的差异。动物试验的免疫原性研究数据并不能简单地直接用于预测人类的免疫反应,在将动物研究成果向人类临床应用转化的过程中,需要更加谨慎地进行评估和分析。
◆ 在部分动物出现眼部炎症后,采用典必殊或百力特等眼局部激素类药物进行治疗后,眼部炎症呈现出明显的恢复趋势。较为严重的眼内炎症也可能引起全身指标的变化,如血液中 CRP、FIB、补体等指标的改变。在较为严重的情况下需要考虑采用系统给药途径免疫抑制剂进行干预。
这一结果不仅表明了对动物使用激素(免疫抑制剂)进行抗炎治疗具有显著的效果,更进一步证明炎症可能是由免疫反应所引起,同时也为临床试验提供了重要的启示:在临床试验中可适当地运用免疫抑制剂来对免疫反应进行有效的预防和治疗,从而为提高基因治疗的安全性和有效性提供有力的保障。
◆ 临床转化价值点
免疫原性引起的眼内炎症在使用免疫抑制剂治疗后通常会看到很好的恢复,同时考虑到免疫抑制剂长期使用可能会引起不良反应(如眼压异常、动物免疫力下降等),所以免疫抑制剂不会长期使用,一般在看到动物明显恢复或使用一定周期后即会停药。但对于部分动物来说,免疫原性可能会持续存在,特别是滴度值维持较高水平的动物,可能会二次出现眼内炎症的情况,甚至出现症状加重的表现,在这种情况下也需要及时进行干预。以上论述提示在临床试验中需要关注免疫原性的持续时间以及使用免疫抑制剂治疗的干预时间。
综上所述,AAV 类基因治疗药物在非临床及临床研究中仍面临着诸多挑战与机遇,深入研究免疫反应的机制和种属差异,以及探索有效的干预措施,将是推动该领域发展的关键所在。
供稿:眼科中心
参考资料:


































































































































