


Arrowhead 依托其专有的 TRiMTM 技术平台,开发了多个靶向中枢神经系统(CNS)的 siRNA 疗法。通过模块化设计与优化,显著提升了 siRNA 分子的递送效率和组织特异性,展现了其在 CNS 疾病领域的技术突破与临床转化潜力。
本文复盘了 Arrowhead 在 CNS 疾病领域的创新经验,对于当前如火如荼的 CNS 药物的研发或可借鉴,一齐静待 CNS 研发春天的到来。
全文共:7093 字 28 图
预计阅读时长:20 分钟
中枢神经系统(CNS)疾病因其复杂性而成为医学领域尚未被有效解决的重大挑战。这类疾病涵盖了脊髓小脑共济失调、阿尔茨海默病、帕金森病、多发性硬化症、亨廷顿舞蹈症等多种严重影响人类健康,且具有高度异质性和治疗难度的病症。尽管传统小分子药物在某些 CNS 疾病的治疗中取得了一定的进展,但其疗效往往受限于靶点选择性不足和药代动力学问题。此外,部分 CNS 疾病由于血脑屏障(BBB)的存在,使得外周递送的药物难以有效到达病灶部位,进一步限制了治疗效果。
在这种背景下,以寡核苷酸药物(Oligo)为代表的精准靶向疗法应运而生,正推动整个行业从传统小分子向其加速迭代。凭借其独特的序列特异性作用机制和可控的药代动力学特性,Oligo 逐渐成为治疗 CNS 疾病的重要方向之一。这类药物基于核酸的互补配对原则,能够精确地靶向特定基因或 mRNA 分子,从而实现对致病蛋白表达的调控。其优势在于双重精准性:既可针对疾病的遗传根源进行治疗,又能在空间上靶向 CNS 病灶部位,显著减少外周副作用的发生。
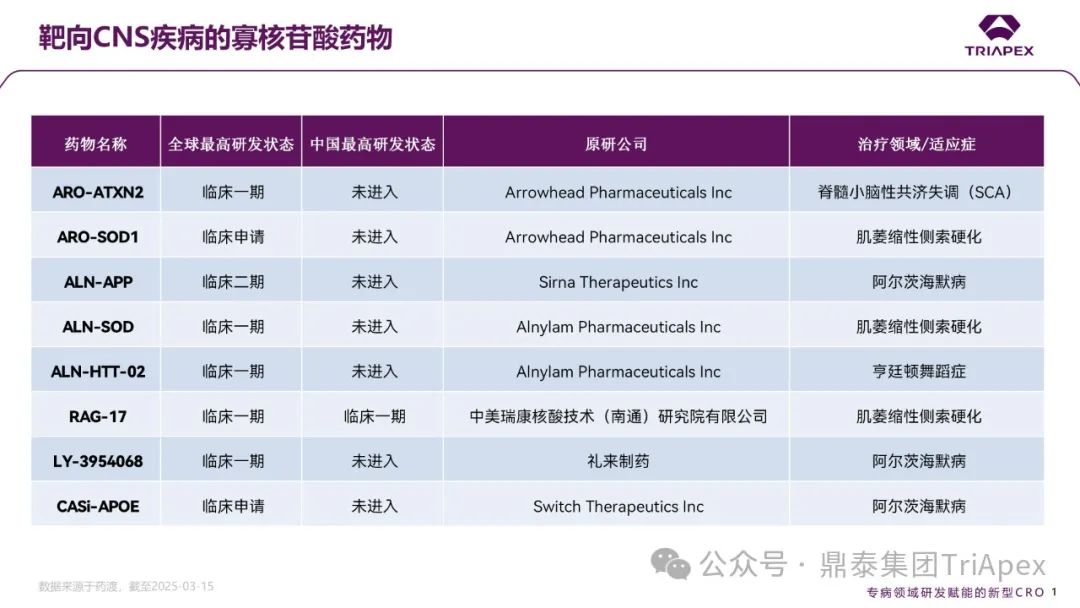
图1. 靶向 CNS 疾病的寡核苷酸药物(数据来源于药渡,截至2025-03-15)
近年来,多项专利技术的出现为克服上述难题提供了新的解决方案。例如,Wave Life Sciences 的 PN 化学修饰反义寡核苷酸(ASO)专利,通过对 ASO 进行独特的化学修饰,显著改善了其在体内的稳定性和靶向递送效率,进一步提升了疗效并降低了潜在的不良反应。Ionis 开发的 SCM-LICA 递送技术致力于解决 ASO 在脑靶向递送方面的难题,推动了药物在脑靶向递送与稳定性上的持续进化。
Arrowhead Pharmaceuticals 则基于其专有的 TRiMTM 技术平台开发了 CNS 靶向的 siRNA 疗法,其中 ARO-ATXN2 作为其 CNS 管线中治疗脊髓小脑共济失调候选药物,已进入 I/II 期临床试验。此外,后续产品的持续创新进一步彰显了 TRiMTM 平台的技术潜力,也为 CNS 疾病的治疗开辟了新的可能性。本期文章,鼎泰团队将深度解析其技术突破与管线布局,揭示 siRNA 如何改写 CNS 药物研发的未来图景,也从中汲取有助于指导当下非临床研究和临床开发的有益经验。
★ 文章导览★
01 | CNS 递送的难点与挑战 |
02 | CNS-Targeting TRiMTM 平台解析 |
03 | CNS 创新管线研究进展 |
04 | 结语 |
05 | 鼎泰赋能 |
CNS 递送的难点与挑战
CNS 药物递送是医学领域的核心挑战之一。尽管全球范围内 CNS 疾病(如脑肿瘤、神经退行性疾病等)的发病率持续攀升,但传统治疗手段受限于脑内复杂的生理屏障和微环境特性,超过 98% 的小分子药物和几乎全部大分子治疗剂难以有效递送至病灶区域。这一困境不仅源于血脑屏障的天然防御机制,更涉及递送系统设计、药物代谢动力学以及跨物种模型转化等多维度科学难题。具体挑战可归结为:
穿透屏障难:BBB 仅允许极少数小分子被动扩散,大分子药物(如抗体、siRNA)几乎无法穿透,而主动运输策略(如转铁蛋白受体介导)易引发肝脾脱靶。
分布与滞留差:突破 BBB 后药物因脑内微环境异质性难以靶向富集(病灶浓度不足血浆 1/10),且受脑脊液循环和外排泵清除影响需频繁给药。
载体安全性矛盾:病毒载体存在预存免疫风险,化学载体可能激活胶质细胞引发炎症。
模型转化鸿沟:动物与人类 BBB 结构差异显著,导致超 80% 阿尔茨海默病药物临床失败。
因此,破解上述难题,需从靶向递送、长效控释与精准调控三大维度实现技术跃迁。
CNS-Targeting TRiMTM 平台解析
Arrowhead 在 CNS 药物研发中,构建了两代 CNS-Targeting TRiMTM 平台,分别针对鞘内给药和皮下给药两种方式。
1
第一代TRiMTM 平台:鞘内给药的突破
鞘内给药是指在腰椎或小脑延髓池部位将药物直接注射到包含脑脊液的鞘囊中的给药方式。
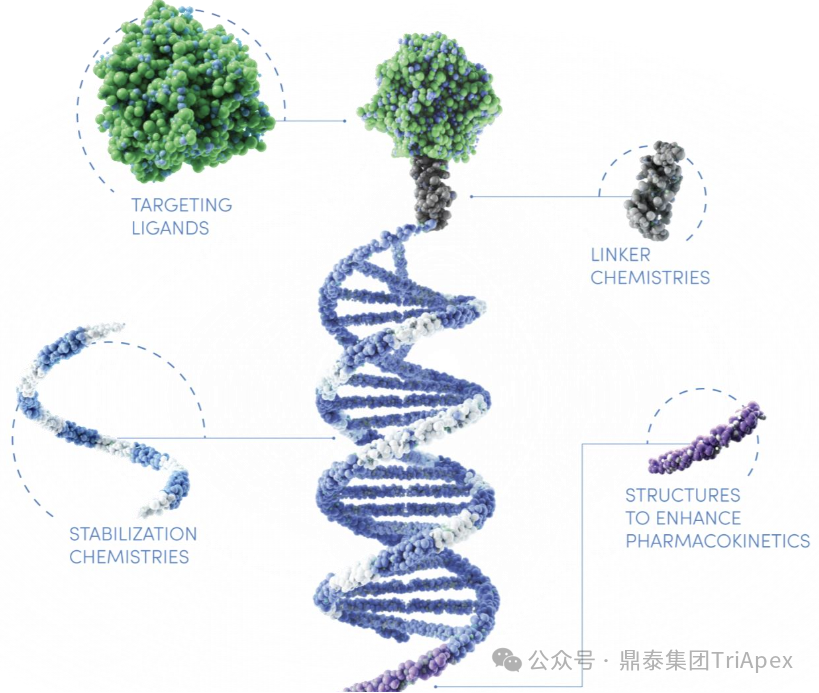
图2. 优化的 CNS 鞘内给药平台 (2024)
简洁的脂质偶联物设计:通过脂质与 siRNA 的偶联,提高其生物相容性,siRNA 更易穿透细胞膜,增强药物在 CNS 中的稳定性和递送效率;
有效的 mRNA 消除:精准靶向,显著降低目标基因 mRNA 的表达;
广泛的体内分布:药物可在神经元、星形胶质细胞、小胶质细胞等发挥作用,覆盖 CNS 各区域;
持久的疗效:一次给药即可维持长期的基因敲低效果,可实现每月或每季度给药,减少了用药频率;
安全性良好:临床前研究显示,无严重不良反应;
代表性产品:靶向 ATXN2 基因,用于治疗脊髓小脑共济失调2型(SCA2)的 ARO-ATXN2。
2
下一代平台:皮下给药的前沿创新
在鞘内给药技术取得突破性进展的基础上,Arrowhead 通过持续创新实现了从侵入性给药向非侵入性治疗的跨越式发展。第一代 TRiMTM 平台通过脂质偶联技术已证实 CNS 靶向治疗的可行性,而新一代皮下给药平台则通过转铁蛋白受体(TfR1)靶向配体技术,成功突破血脑屏障的递送瓶颈。这种从"直接注射"到"系统给药"的转变,不仅保留了药物在神经元、胶质细胞中的广泛分布特性和季度给药的持久疗效,更通过皮下注射的便捷方式显著提升患者依从性,为神经退行性疾病的长期管理提供了更优解决方案。

图3. 优化的 CNS 皮下给药平台 (2024)
配体驱动递送,突破血脑屏障:利用 TfR1 靶向配体与 siRNA 结合,药物可穿透血脑屏障,实现脑内递送;
有效且持久的基因表达降低:持续抑制 MAPT mRNA 的表达,减少 Tau 蛋白的合成,对异常的 Tau 蛋白聚集与多种神经退行性疾病疗效显著,可实现每月或每季度给药;
便捷的给药方式:相比鞘内给药,皮下给药更加方便;
安全性良好:在啮齿类动物和非人灵长类动物中,超过治疗剂量 10 倍的给药也表现出良好的耐受性;
代表性产品:靶向 ANGPTL3 基因,用于治疗家族性高胆固醇血症(HoFH);靶向 MAPT 基因,用于治疗阿尔兹海默病的 ARO-MAPT。
CNS 创新管线研究进展
基于上述递送平台,Arrowhead 针对多种 CNS 疾病,开发了多条创新管线,以下是其中的三个重点项目。
1
ARO-ATXN2:
治疗脊髓小脑共济失调2型(SCA2)
脊髓小脑共济失调2型是一种由 ATXN2 基因 CAG 重复序列异常扩增导致的常染色体显性遗传神经退行性疾病,主要表现为进行性小脑共济失调,约占所有脊髓小脑共济失调病例的 15-20%,患者平均发病年龄为30岁,发病后生存期约为10至20年。
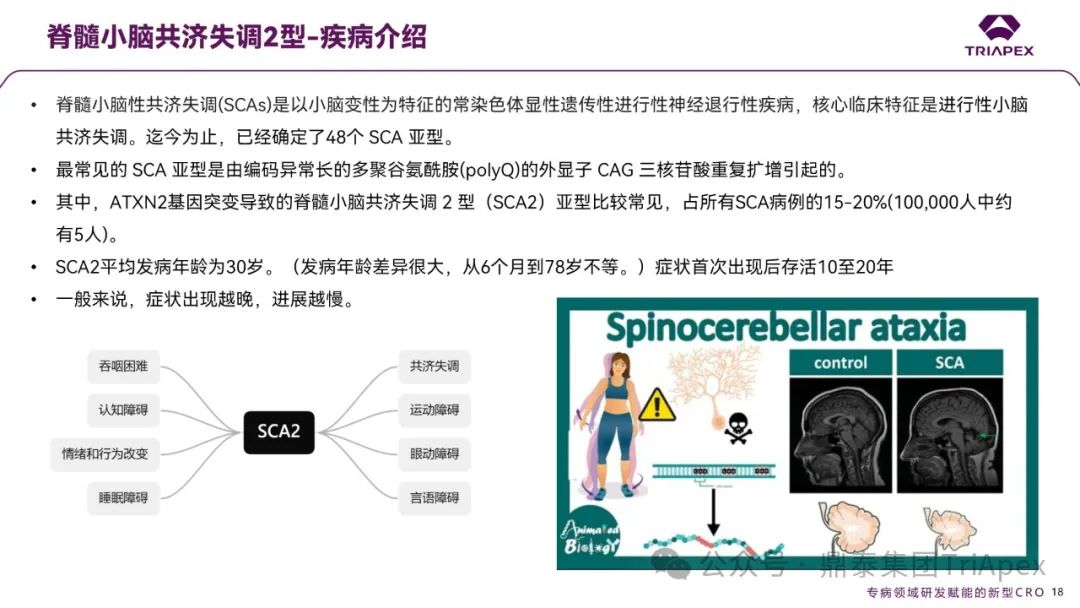
图4. SCA2 的疾病介绍
(1)致病机制
神经细胞退化:小脑浦肯野细胞的损失,导致小脑萎缩;
蛋白质聚集:在神经细胞质中发现蛋白质微聚集体;
细胞功能障碍:蛋白质聚集导致细胞信号传导干扰、氧化应激增加等。

图5. SCA2 的致病机制
(2)治疗策略
针对 SCA2 的多维治疗策略聚焦于致病机制的关键环节,包括:基因层面干预、细胞功能修复、钙稳态调控和蛋白聚集阻断。四重策略分别从基因表达调控、神经保护、离子平衡重建与构象毒性消除切入,形成覆盖 SCA2 全病理链条的协同治疗网络。

图6. SCA2 的治疗策略
(3)药物研发进展
SCA2 的药物研发进程如下图所示,包括用于谷氨酸调节的 BHV-4157(Troriluzole)、神经营养类的 NeuroEPO,以及通过降低 ATXN2 蛋白水平的 ENZ-002 和 ASO07。
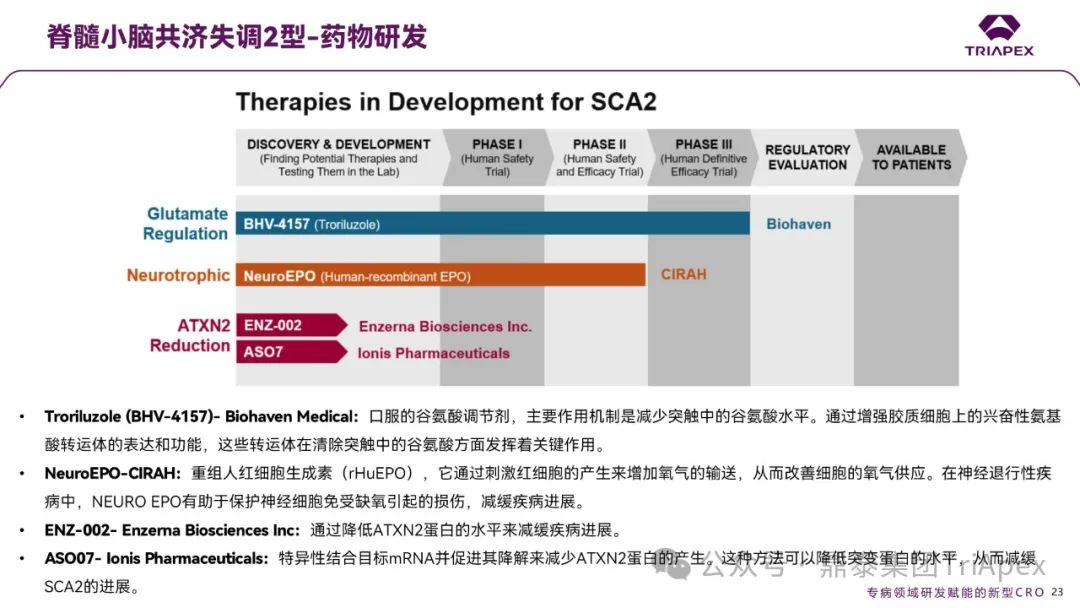
图7. SCA2 的药物研发
根据药渡数据库的最新数据,ARO-ATXN2 目前处于临床试验的 I/II 期随机、双盲、安慰剂对照试验阶段,计划招募 36 例 18-65 岁确诊患者,旨在评估其安全性和降低 ATXN2 蛋白表达的效果。2024年11月,Sarepta Therapeutics 已与 Arrowhead Pharmaceuticals 达成协议,负责推进 ARO-ATXN2 的后续开发,目前试验队列已开放患者入组,预计2026年9月完成研究。

(4)ARO-ATXN2 非临床研究进展
ARO-ATXN2 利用合成的 siRNA,与 ATXN2 基因的 mRNA 特异性配对,形成双链 RNA 结构,细胞内的 RNA 诱导沉默复合物(RISC)识别并结合这一区域,导致 ATXN2 mRNA 被切割和降解,从而降低 Ataxin-2 蛋白水平,减少有害的蛋白聚集,减轻神经元损伤,达到延缓疾病进程的目的。
ARO-ATXN2 在 BAC-Q22 ATXN2 转基因小鼠小脑中的效能
ARO-ATXN2 在单次侧脑室注射(ICV)给药的 BAC-Q22 ATXN2 转基因小鼠模型中表现出显著的剂量依赖性基因沉默效果:
mRNA 水平:所有剂量组(10、30、100、300 μg)均显著降低小脑中 ATXN2 mRNA 水平,且低剂量(10 μg)即可达到 IC50 < 10 μg,表明其强效性;
蛋白水平:随着剂量升高,ATXN2 蛋白表达同步下降,与 mRNA 抑制趋势一致,证实了 RNAi 机制的有效性。
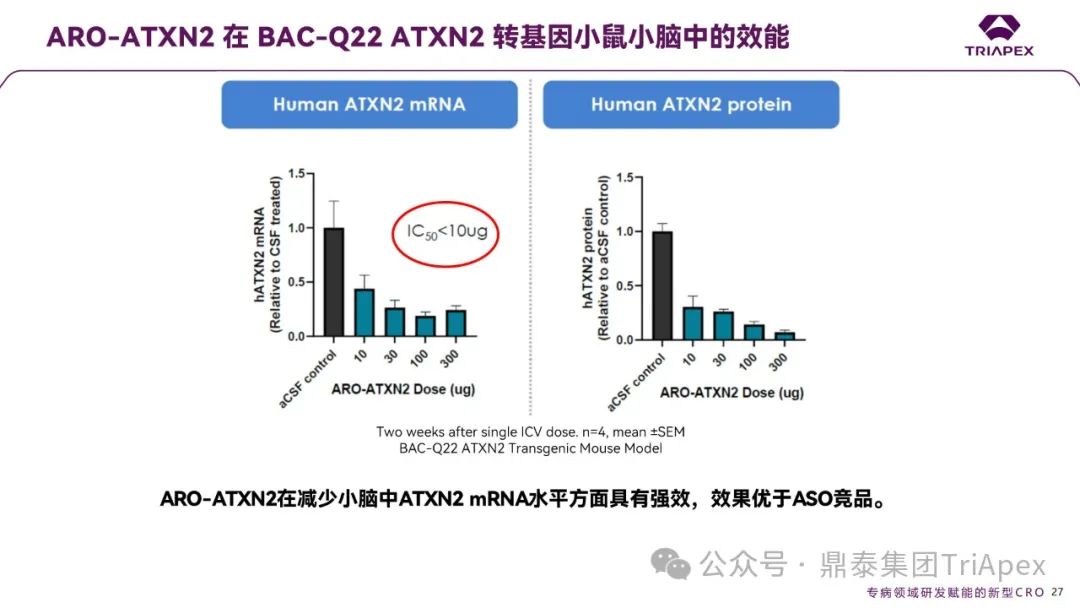
图8. ARO-ATXN2 在 BAC-Q22 ATXN2 转基因小鼠小脑中的效能
ARO-ATXN2 在 NHP CNS 区域的效能
ARO-ATXN2 在非人灵长类动物(NHP)CNS 中展现出显著的剂量依赖性蛋白沉默、显著的剂量和时间依赖性基因沉默效果:
在单次鞘内注射(IT)后第 29 天,小脑区域的 ATXN2 蛋白水平较对照组降低 83%(60 mg剂量组),且所有剂量组(5-60 mg)在腰髓、颈髓、额叶皮质及脑桥等区域均呈现剂量依赖性抑制趋势。其中,60 mg剂量组在多个关键区域(如小脑、腰髓)的蛋白抑制效果最为显著,而 5 mg剂量组已显示出基础抑制作用,表明 ARO-ATXN2 具有强效且广谱的 CNS 靶向能力;
RNA 水平:浦肯野细胞(黄色标记)中紫色 ATXN2 mRNA 信号在 60 mg剂量组(ID 2001/2010)显著减少,表明 ARO-ATXN2 有效靶向并降解致病 mRNA;
蛋白水平:与对照组(aCSF)相比,单次 60 mg鞘内注射后,小脑区域 ATXN2 蛋白在第 29 天即被显著抑制,且效果持续至第 85 天,证实其长效性。
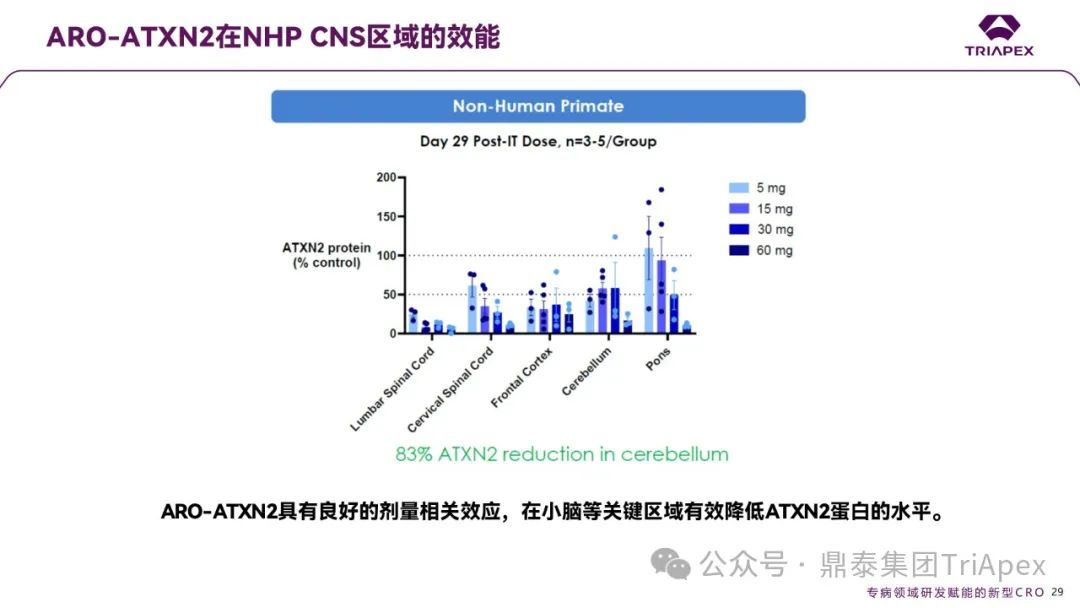
图9. ARO-ATXN2 在非人灵长类 CNS 区域的蛋白水平
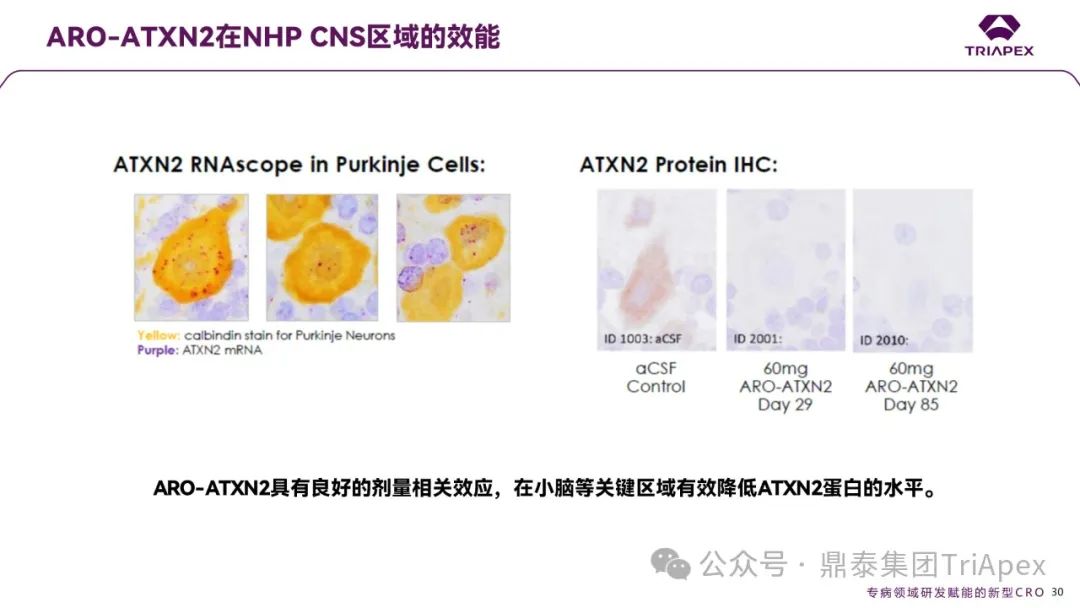
图10. ARO-ATXN2 在非人灵长类 CNS 区域的 RNA 水平
整体而言,ARO-ATXN2 在小鼠及非人灵长类动物模型中的非临床研究,成功验证了其通过 RNAi 机制调控 ATXN2 表达的可行性,无论是在小鼠模型中的强效基因沉默,还是在非人灵长类 CNS 中的广谱长效靶向效果,均彰显出该疗法的巨大潜力。遗憾的是,目前未查询到 ARO-ATXN2 详细的非临床安全性评价试验结果,无法在此进行详细解读,但从 Arrowhead 研发网络研讨会上披露的信息可以看到,ARO-ATXN2 的临床前安全性数据整体积极,未发现严重毒性反应,为其进入人体试验奠定了基础。
2
ARO-MAPT:阿尔茨海默症(AD)的新希望
阿尔茨海默病是一种导致记忆丧失和认知衰退的进行性神经性疾病,是最常见的痴呆症,影响着全球数百万人,目前尚无治愈方法。
图11. 阿尔兹海默症疾病介绍
(1)致病机制
淀粉样蛋白级联假说:与大脑中淀粉样蛋白的积累有关;
Tau 蛋白过度磷酸化假说:Tau 蛋白的异常磷酸化导致其稳定性降低,从而形成神经纤维缠结(Neurofibrillary Tangles, NFTs),导致神经细胞功能的损害;
神经炎症假说:大脑中的炎症反应,对 Aβ 蛋白的积累和神经退行性病变起了推动作用;
氧化应激假说:氧化应激可以导致神经元损伤和死亡;
血管假说:血管功能障碍可能增加 AD 的风险;
微生物组假说:肠道微生物组与 AD 之间的关系,探讨肠道微生物如何通过影响炎症和神经免疫途径与大脑相互作用;
自噬功能障碍: 自噬是细胞内的一种自我清理机制,用于降解和回收细胞内的废物。在 AD 中,自噬功能受损可能导致有害物质在细胞内积累。

图12. 几种 AD 致病机制假说 (Atsadang Theerasri, 2023)
(2)治疗策略
阿尔兹海默症的治疗策略涵盖多方面,包括管理认知和行为症状的对症治疗,针对淀粉样蛋白 β 和 tau 蛋白病理的疾病修饰治疗,以及其他策略如激酶抑制剂和抗炎剂,以应对神经炎症和其他潜在机制。

图13. 阿尔兹海默症治疗策略
(3)药物研发进展
阿尔兹海默症药物研发管线主要聚焦疾病修饰治疗,以淀粉样蛋白、tau 蛋白为靶点的生物制剂为主导,同时涵盖神经炎症、氧化应激、肠道-脑轴等新兴机制。
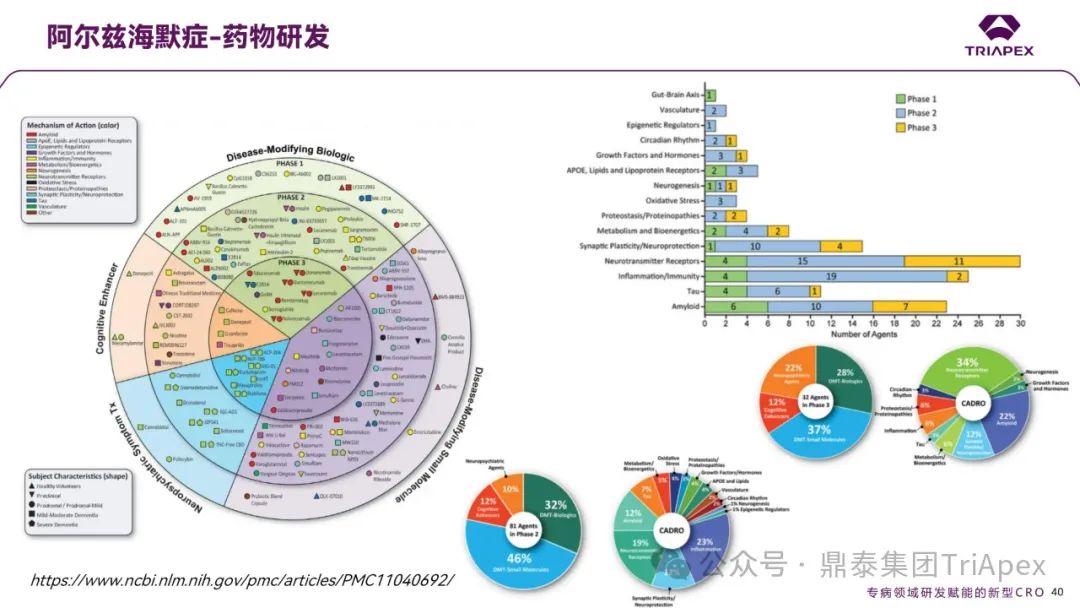
图14. 阿尔兹海默症药物研发
(4)ARO-MAPT 非临床研究进展
在上文中我们提到,Arrowhead 通过持续创新实现了从侵入性给药向非侵入性治疗的跨越式发展,新一代皮下给药平台通过 TfR1 靶向配体技术,成功突破血脑屏障的递送瓶颈。其中最具代表性的是 ARO-MAPT,通过皮下给药给药方式,可以靶向中枢,降低各个脑区 MAPT 基因(编码 Tau 蛋白)的表达,从源头上减少 Tau 蛋白的异常聚集。
ARO-MAPT 通过皮下给药在 NHP CNS 中 MAPT mRNA 的浓度
ARO-MAPT SC 通过皮下给药在非人灵长类动物 CNS 中实现了广泛且深度的 MAPT mRNA 敲低:
脑区特异性抑制:经 3 次 3 mg/kg 皮下给药后,第 29 天各脑区 MAPT mRNA 水平显著降低,其中脊髓腰段(Lumbar)抑制率达 85%,前额皮质(Frontal cortex)和运动皮质(Motor cortex)分别降低 80% 和 75%,丘脑(Thalamus)及海马(Hippocampus)等区域也呈现显著抑制(均>70%),表明药物具有全 CNS 覆盖能力;
显微图像验证:海马区对照组(aCSF)神经元内可见密集的紫色 MAPT mRNA 信号(标记为 RNAscope 阳性),而 ARO-MAPT SC 处理组信号显著减少,证实药物在细胞水平的高效沉默效果。
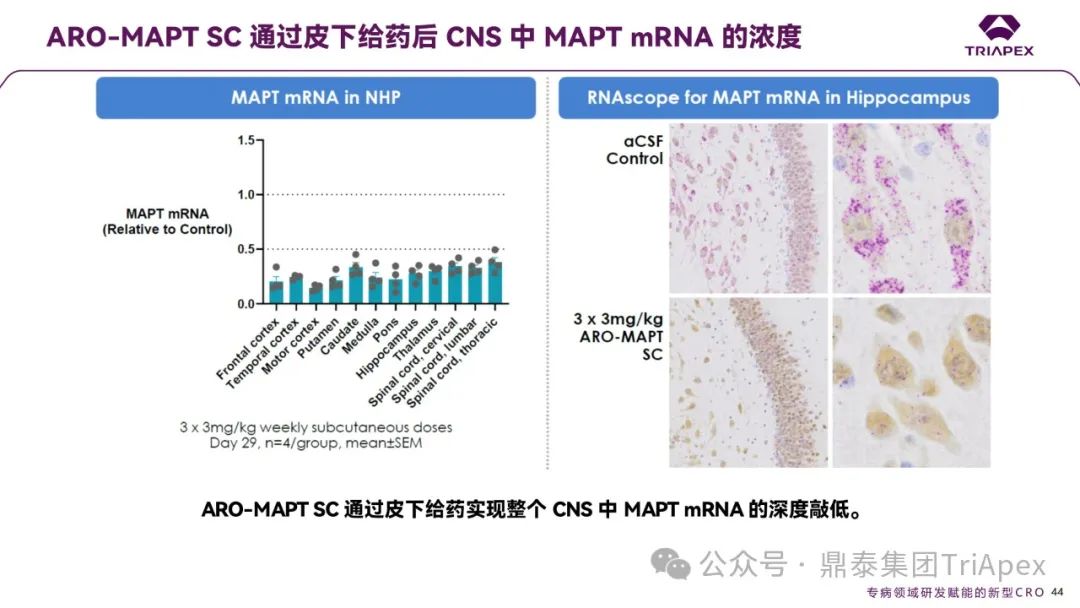
图15. ARO-MAPT 通过皮下给药在 NHP CNS 中 MAPT mRNA 的浓度
ARO-MAPT 借助 TfR1 靶向配体技术实现皮下给药方式,展现出对 NHP CNS 中 MAPT 基因表达的强大抑制能力,有望在后续研究中进一步优化并推进临床应用。但目前未查询到 ARO-MAPT 详细的非临床安全性研究数据,无法在此进行详细解读,我们将持续关注后续进展并为大家分享。
3
ARO-HTT:亨廷顿舞蹈症(HD)的治疗突破
亨廷顿舞蹈症是一种罕见的遗传性神经退行性疾病,以不自主的舞蹈样运动和精神认知障碍为特征,呈常染色体显性遗传,多发于中年人,但也可在任何年龄发病,全球患病率约为 5 至 10 例每 10 万人。
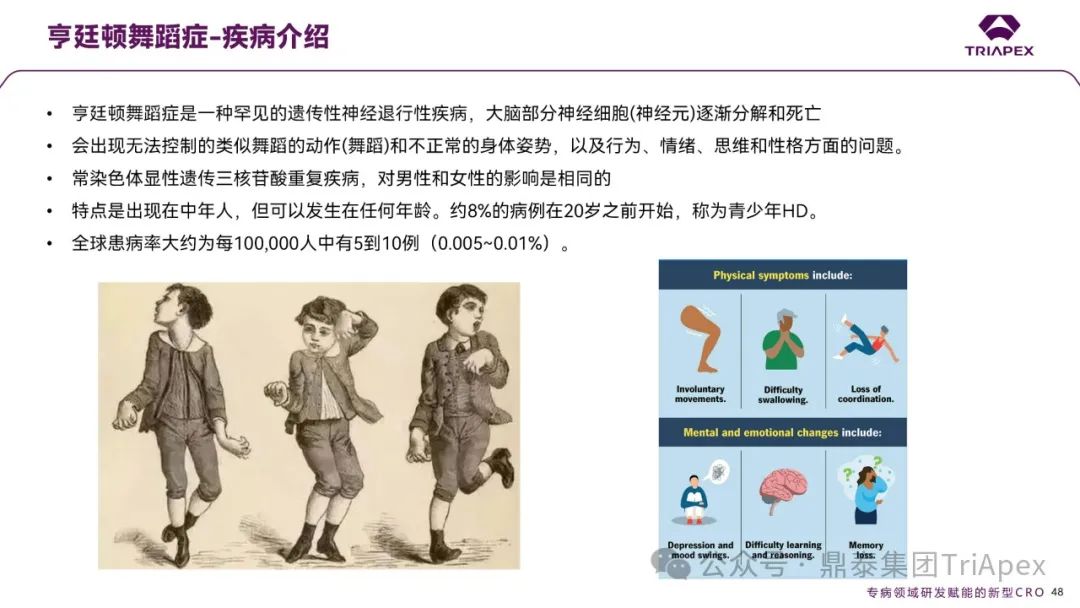
图16. 亨廷顿舞蹈症疾病介绍
(1)致病机制
HTT 基因突变:导致亨廷顿蛋白异常聚集,损害神经元功能。
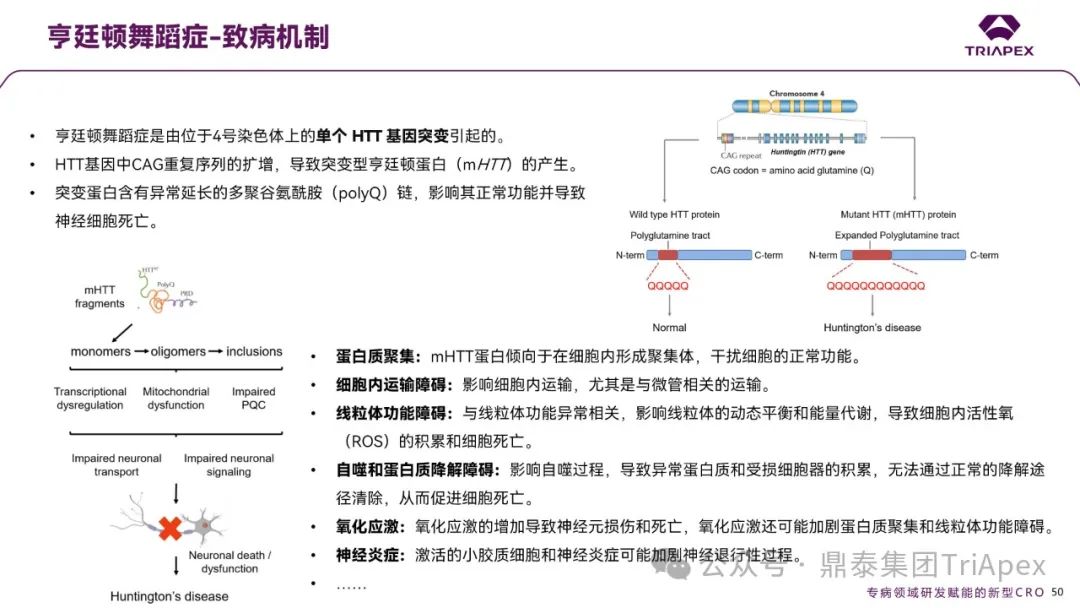
图17. 亨廷顿舞蹈症致病机制
(2)治疗策略
亨廷顿舞蹈症的治疗策略主要针对突变的 HTT 基因及其表达产物,通过基因沉默技术破坏突变 HTT mRNA,减少有害蛋白的产生,同时结合蛋白清除和免疫疗法来减轻病情。这些策略旨在抑制突变 HTT 蛋白的聚集,保护神经元功能,从而延缓疾病进展。
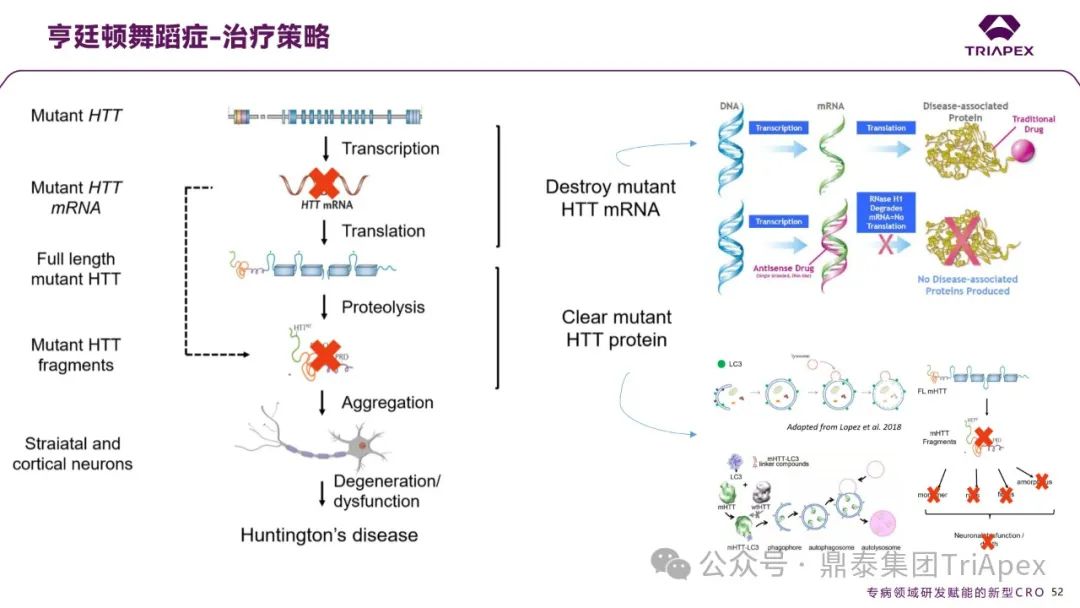
图18. 亨廷顿舞蹈症治疗策略
(3)药物研发进展
亨廷顿舞蹈症药物研发呈现多元化探索格局:目前已有三款 VMAT2 抑制剂获 FDA 批准上市,主要用于调节多巴胺水平以控制运动症状。在研管线涵盖基因疗法、ASO、RNA 剪接调节剂、神经炎症抑制剂等创新机制。

图19. 亨廷顿舞蹈症药物研发
(4)ARO-HTT 非临床研究进展
ARO-HTT 通过 RNAi 技术,靶向降低 HTT 基因的表达,减轻亨廷顿蛋白的毒性作用。
ARO-HTT 先导化合物的效力
ARO-HTT 先导化合物在两种给药途径下均展现出剂量依赖性的强效 HTT 基因沉默能力:
鞘内给药:在 YAC128 HD 小鼠模型中,单次鞘内注射 300 μg 剂量显著降低纹状体(Striatum)突变 HTT 蛋白(mutHTT)水平至对照组的 20%(抑制率约 80%),且低剂量(30 μg)已显示明显抑制作用;
系统给药:通过皮下注射(4 次 3 mg/kg剂量)在 hfr 转基因小鼠中实现全 CNS 覆盖,纹状体、皮质(Cortex)及胸髓(Thoracic spinal cord)的 HTT mRNA 抑制率分别达 85%、80% 和 75%,且效果显著优于竞品 ASO 和传统 siRNA。
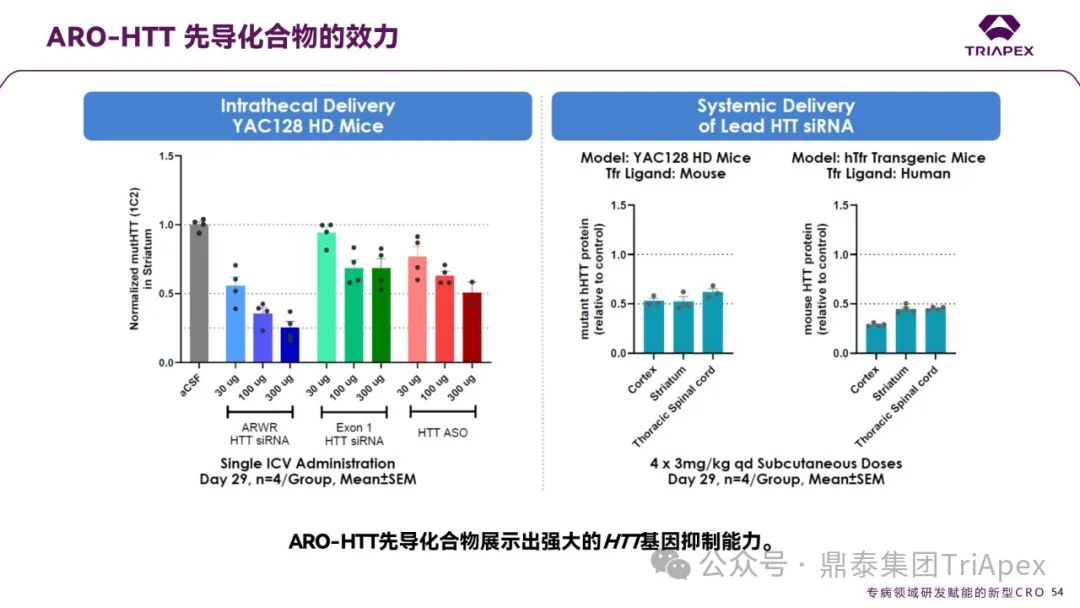
图20. ARO-HTT 先导化合物的效力
ARO-HTT SC 在疾病相关脑区的治疗效果
ARO-HTT SC 通过皮下给药在 NHP CNS 中实现了剂量依赖性且广泛的 HTT 蛋白沉默:
剂量效应:在 3 次皮下注射(3x3 mpk剂量组)后第 43 天,所有疾病相关脑区的HTT蛋白水平均显著降低,其中壳核(Putamen)和尾状核(Caudate)的蛋白抑制率超过75%,颞叶皮质(Temporal Cortex)和前额叶皮质(Frontal Cortex)的抑制率也达 70% 以上;
剂量梯度:低剂量组(3x0.3 mpk)已显示出基础抑制作用,而高剂量组(3x3 mpk)在所有脑区均实现深度沉默。
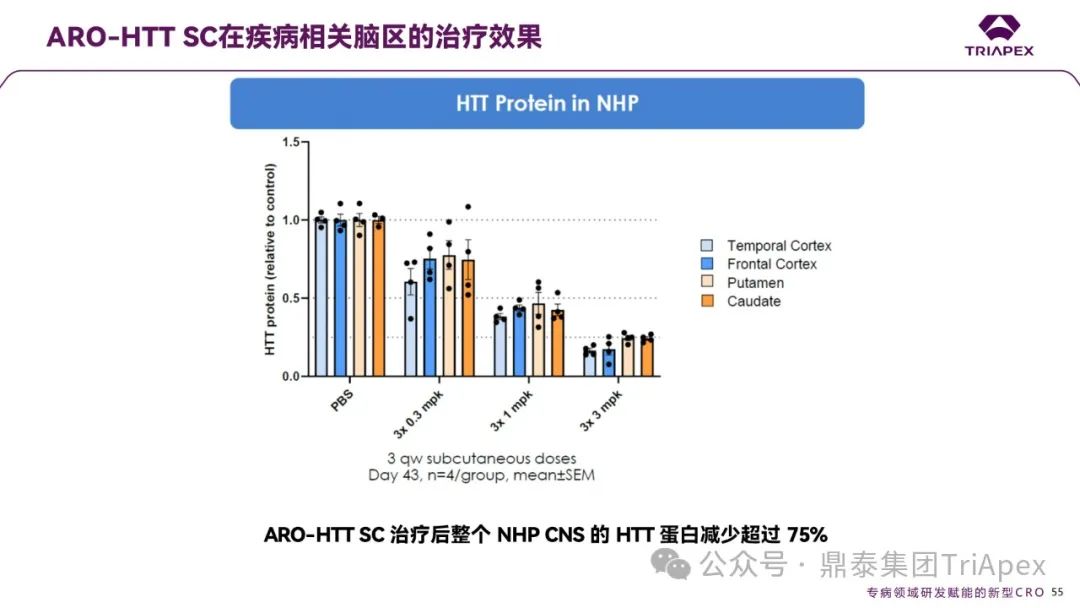
图21. ARO-HTT 皮下注射后再疾病相关脑区的治疗效果
ARO-HTT 通过鞘内、皮下给药途径,在小鼠模型中均展现出对 HTT 基因表达的强效抑制能力,也侧面提示了其递送策略的有效性;在非人灵长类动物的 CNS,ARO-HTT 也实现了在不同脑区显著的蛋白沉默效果。但目前亦未查询到 ARO-HTT 详细的非临床安全性研究结果,无法在此进行详细解读,我们将持续关注后续进展并为大家分享。
结语
Arrowhead 基于其独有的 TRiM™ 技术平台,展现了其在 CNS 疾病 siRNA 药物研发的独特价值和创新思维。从第一代鞘内注射递送技术(如ARO-ATXN2)到第二代配体介导的跨屏障递送系统(靶向 TfR1 受体的皮下给药),Arrowhead 通过递送技术迭代成功突破血脑屏障递送瓶颈;结合创新性脂质偶联物技术实现长效缓释(ARO-MAPT 单次给药即可实现长达数月的基因沉默效应),并基于 RNA 干扰机制精准靶向致病基因(特异性切割 ATXN2、MAPT、HTT mRNA),构建了以“靶向递送-长效控释-精准调控”三位一体为开发逻辑。未来通过临床转化与多维度技术升级(新配体筛选、AI 靶点预测、缓释剂型优化),有望将神经退行性疾病治疗模式从“延缓症状”推进至“单次给药、长效逆转”的新阶段,为阿尔茨海默病、亨廷顿病等缺乏有效疗法的领域提供突破性解决方案。
基于 Arrowhead 在靶向 CNS 疾病的 siRNA 药物研发逻辑和经验,我们可以得到很多启发:突破血脑屏障的技术创新、精准递送系统的设计优化、以及对神经病理机制的深入理解是成功的关键要素;在研发早期,非临床研究承担着对上述关键要素进行概念验证的重要任务,表现在:
在非临床药效学研究中,通过精准量化基因沉默效率验证递送系统突破 BBB 及有效靶向致病 mRNA 的能力;基于疾病动物模型的概念验证(POC)研究,不仅可证实 RNAi 技术对相关病变的干预潜力,还通过剂量-效应关系锚定临床起始剂量;
PK 研究则揭示药物在脑脊液循环与外排泵作用下的时空分布规律,为解释药效和毒理发现,以及指导临床给药方案设计提供关键依据;
毒理学研究通过跨种属安全性评估,系统评估脂质偶联物的安全性(如潜在的胶质细胞激活风险),确保治疗窗口的合理性。
这些多维度的非临床数据构建起从靶点验证到临床转化的科学桥梁。
鼎泰赋能
在全球 CNS 药物研发热度持续攀升的行业背景下,鼎泰集团紧密围绕 CNS 药物研发中靶向递送、疗效验证、转化医学等关键痛点,构建了具有前瞻性的非临床解决方案。通对 Arrowhead 先进研发经验的深入学习,进一步优化和完善了 CNS 疾病 siRNA 药物非临床评价方法和策略,致力于推动从靶点验证到临床开发的高效转化。
目前,鼎泰集团已建立 NHP 与啮齿类动物立体定位注射技术体系,涵盖侧脑室/纹状体/海马/鞘内注射等多种给药途径,成功突破 BBB 递送技术瓶颈;同时,整合神经行为学和在体电生理等前沿技术,开发了 AD 和 PD 等疾病模型,助力临床前与临床转化研究的深度衔接;依托自主、可控的实验动物繁育基地,实现了优质 NHP 的稳定供应。遵循 FDA/EMA/NMPA 法规,鼎泰集团可开展完备的支持早期发现和 IND/NDA 申报所需的药效、PK 和毒理学等核心研究。
通过聚焦技术难点进行服务升级的战略部署,鼎泰集团不仅提升了综合服务能力,更夯实了在 CNS 药物开发领域的差异化优势。凭借对创新技术的持续投入和卓越的技术服务能力,鼎泰正为全球新药研发注入强大动能。
供稿:毒理Ⅱ部
参考资料:


































































































































