


作为一种新兴的治疗手段,寡核苷酸药物(Oligonucleotide therapeutics,ONTs)不仅在罕见病领域展现出良好的应用前景,在其他慢性疾病治疗领域(如高血压和高血脂等)也显示出巨大的开发潜力[1,2]。至 2024 年 9 月,全球范围内已有 20 种 ONTs 获批上市[3]。目前,国内已有 2 款产品获批上市,并有越来越多的 ONTs(主要为 siRNA)进入临床开发阶段,有的即将启动关键性临床试验。在这些临床试验中,除了关注疗效以及对受试者的安全性、耐受性之外,从伦理和监管角度考虑,对于受试者潜在生殖发育毒性风险的关注度将越来越高,这些风险通常通过动物试验进行评估。按照 ICH M3(R2)等指导原则,在启动后期关键性临床试验之前需开展相应的生殖发育毒性(Developmental and Reproductive Toxicology,DART)研究。
早在 2014 年,有白皮书报道了当时对于 ONTs 生殖发育毒性试验相关的考虑和案例分析,指导了很多后来上市药物的研发[4]。2023 年,HESI 通过问卷调查更新了关于 ONTs 生殖发育毒性评价的实践。


鼎泰集团对 ONTs 的非临床研究有着丰富的经验,在前期的系列文章中对已上市 ONTs 产品的临床开发路径和上市历程、寡核苷酸药物药效学研究和杂质控制策略、临床药理学(点击文字查看往期内容)等进行了系统的梳理。本期主题将聚焦 ONTs 生殖发育毒性研究的开展策略、设计原则、关注点、鼎泰集团平台研究能力等内容,以便为更多的 ONTs 药物的后期开发提供有力支持。
全文共:10457 字 20 图
预计阅读时长:27 分钟
★ 文章导览 ★
01 | 寡核苷酸药物概述及产生生殖发育毒性的物质基础 |
02 | 寡核苷酸药物生殖发育毒性研究设计基本原则和开展策略 |
03 | 寡核苷酸药物生殖发育毒性研究设计注意事项 |
04 | 已上市寡核苷酸药物生殖发育毒性研究案例概述及启示 |
05 | 鼎泰集团寡核苷酸药物及生殖发育毒性研究平台简介 |
06 | 结语 |
寡核苷酸药物概述及
产生生殖发育毒性的物质基础
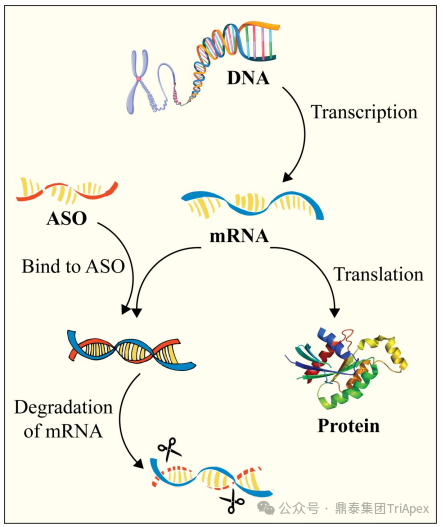
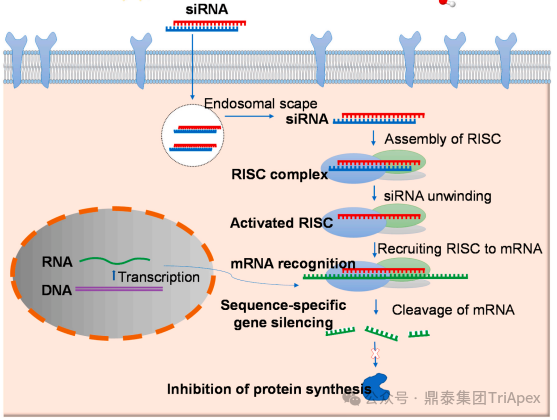
图1 ASO和siRNA药物的作用机制[3][6]
天然寡核苷酸在细胞外稳定性低,易被核酸酶降解,并且由于分子量大和携带负电荷等特性,不易进入细胞。因此,为增强其体内稳定性,通常需要在保留生物活性的前提下进行化学修饰[7]。近年来,ONTs 在化学修饰和合成工艺方面取得了重大突破,这为新型 ONTs 的研发创造了契机。业界已对 ONTs 的序列设计、化学修饰和递送系统等积累了较多的经验,图 2 汇总了全球已上市的 20 款 ONTs 及其化学修饰。尽管如此,对于不同化学修饰的 ONTs 的非临床安全性,尤其生殖发育毒性,仍缺乏系统的认识。
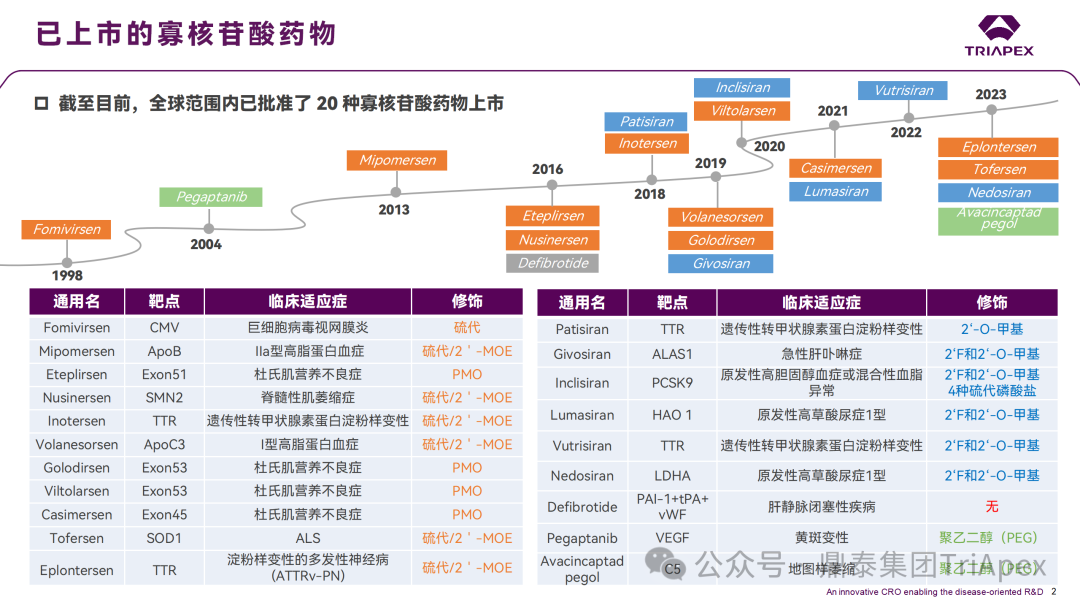
图2 全球已上市的 20 款寡核苷酸药物及其化学修饰汇总
寡核苷酸的骨架结构、药理学活性和脱靶作用均可能造成母体和胚胎-胎仔毒性。由于存在许多不同的结构亚类和生物学机制,单一的研究设计不一定适用于所有 ONTs。因此,需要对每个产品的 DART 进行特定的调整和优化[4],根据不同产品的属性设计科学的非临床安全性评估方案。此外,ONTs 的药理学作用可能与生殖功能和子代发育密切相关,且可能对妊娠维持或胚胎发育产生影响。例如,硫代寡核苷酸易引起免疫毒性,可能产生促炎细胞因子(类似干扰素),导致炎性反应、组织损伤和生殖功能障碍等[8];某些 ONTs 也可在卵巢、胎盘等器官中检测到,可能导致细胞浸润,从而对生殖发育过程产生影响[9]。目前,ONTs 穿过胎盘屏障的机制尚未明确,深入研究胎盘转运机制对于评估其生殖发育毒性和指导药物开发具有重要的意义。
寡核苷酸药物生殖发育毒性
研究设计基本原则和开展策略
▌ 遵循的指南
ONTs 同时具有化学合成的小分子/新化学实体(NCE)和基因重组来源大分子/新生物实体(NBE)的属性[4]。
一方面,ONTs 含有生物系统中非天然的化学部分,应关注其在细胞内的作用以及化学修饰的影响并遵循小分子的非临床安全性评价指南。
另一方面,某些 ONTs 药物特性与生物制剂更相似,包括种属特异性、与内源性分子(即DNA和/或RNA)的结构相似性以及更长的半衰期和/或药效学作用。同时,ONTs 又可能具有脱靶效应。
因此,ONTs 的非临床安全性评价不仅需要参考当前化药及生物制品的指南,还需结合已发布的白皮书及相关文献(详见图 3),并基于每种 ONTs 的产品特性进行评估。
根据 ONTs 的适应症和覆盖的用药人群等因素,通常需要开展生殖发育毒性研究。其试验设计原则上可参考 ICH S5(R3)、S6(R1)及 PMDA《Guideline for preclinical safety assessment of oligonucleotide therapeutics》,实施时间可参考 ICH M3(R2)。
一般可采用分段式试验策略,也可以根据实际需要进行特殊设计,比如生育力与早期胚胎发育毒性联合胚胎-胎仔发育毒性评估的方式,试验设计将取决于特定ONTs的目标患者人群和药理作用[10]。

▌ 关注点和考虑因素
进行生殖发育毒性研究设计时应同时考虑ONTs的化学结构和预期药理学的潜在影响。对特定靶点的抑制作用可能与生殖功能有关,并且在妊娠或胎仔发育的过程中可能会放大药理作用。对于大多数 ONTs,这种评估通常侧重于靶蛋白表达水平或功能降低的影响;还应了解特定靶蛋白的表达情况,以评估药物相关程度。对于 siRNA,评估则通常侧重于 RNA 家族表达增加的影响。
如果胎仔对 ONTs 的暴露量较低,则表明药物对胚胎或胎仔体内靶点直接产生影响的机会可能有限。有关胎盘转移的信息可能有助于评估药物对胚胎和胎仔的影响[11]。与药理学相关的母体生理变化不仅会影响胚胎着床和妊娠维持,还有可能导致胎仔畸形。
总之,开展生殖发育毒性研究前应首先评估靶蛋白的表达情况,以及在胚胎、胎仔、幼龄动物体内和生殖器官及组织中的分布和表达情况,预估靶蛋白表达抑制对生殖的潜在影响[12]。
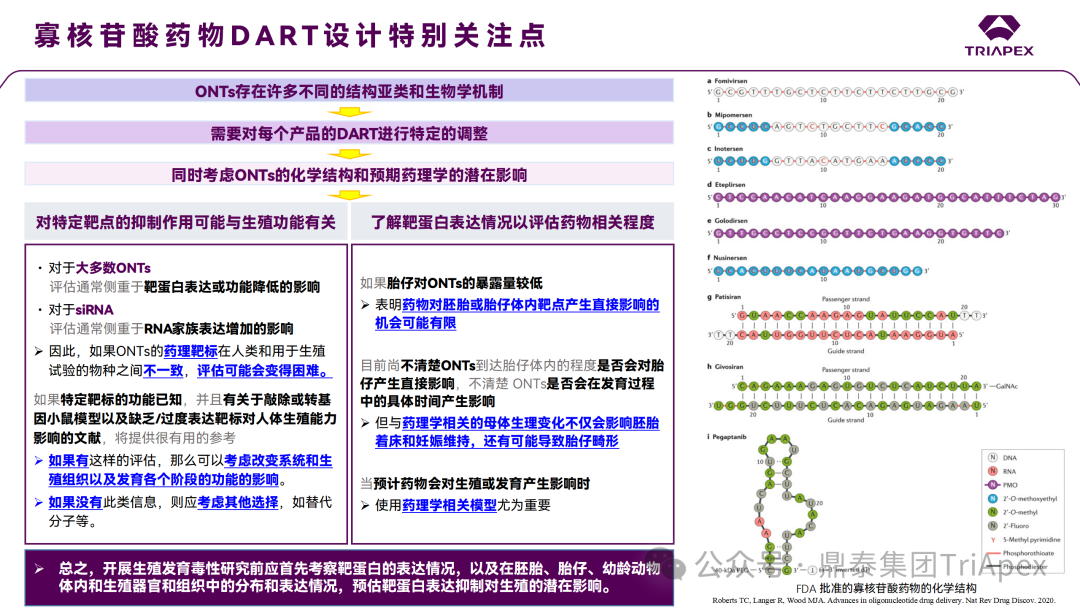
图4 寡核苷酸药物 DART 设计特别关注点[2]
▌ ONTs 生殖发育毒性试验的动物种属
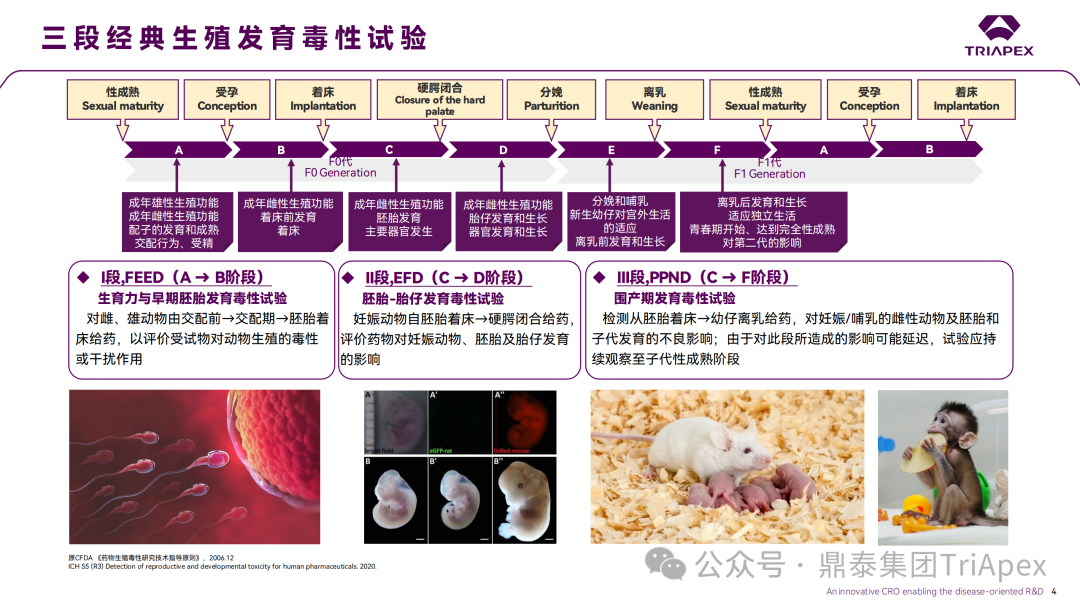
ONTs 的生殖发育毒性研究通常可以在生殖毒性试验常用种属(啮齿类动物/兔)中选择药理学相关种属,以助于解决生殖发育在靶毒性的问题。
通常,采用啮齿类动物进行生育力与早期胚胎发育毒性(Fertility and Early Embryonic Development,FEED)试验和围产期发育毒性(Pre-and Postnatal Development,PPND)试验,采用啮齿类和兔进行胚胎-胎仔发育毒性(Embryo-Fetal Development,EFD)试验。
▌ 替代分子的使用
日本指导原则和白皮书建议[4][11][13][14],当临床分子在啮齿类和兔中无药理学活性时,推荐采用替代分子进行 EFD 试验,替代分子也可用于评估与药理学相关的潜在生殖影响以及与化学主链相关的影响。
NHP 研究应仅在需要回答特定问题或替代分子不适用时使用。但也有文献提到,由于序列依赖性杂交活性的可能性最高且具有可靠的历史背景记录,NHP 是迄今为止用于 ASO 和 siRNA 候选分子非临床研究的最常见非啮齿类动物种属[15]。必须使用NHP时也可考虑开展 NHP 的 ePPND 试验[12],但对于 ONTs,通常需要慎重考虑。特别是,啮齿类和兔生殖毒性风险的形成机制与人存在差异时,例如,诺和泰(Ozempic)的生殖毒性研究(尽管不属于同一类产品)。总之,相关动物种属的选择、给药方案以及是否使用临床候选分子或替代分子需要根据 ONTs 的特定产品属性慎重考虑。此外,当证据权重分析(如作用机制、基因修饰动物的表型数据、同类分子的类效应等)提示供试品存在对生育力或者妊娠结局方面具有明显的不良反应时,足以提供充分的信息来提示生殖风险,则不需要开展额外的生殖发育毒性试验。
综上,国际上尚未形成统一的用于指导 ONTs 生殖发育毒性试验的指导原则。ICH 指南及 ONTs 相关白皮书为 ONTs 生殖发育毒性试验的基本设计提供了理论指导,同时也需要基于科学性原则,通过个例分析进行 ONTs 非临床研究评估。各国监管机构和 ICH 等正在积极规划与 ONTs 非临床安全性评估有关的工作,以期形成科学指导 ONTs 研发的指南。ONTs 的成功开发取决于不同情形采用适当的动物模型,进行可行的临床前安全性评估,从而为患者提供最佳安全信息[4][11]。
寡核苷酸药物
生殖发育毒性研究设计注意事项
基于 01 章节中所述的 ONTs 产生生殖发育毒性的物质基础,在生殖发育毒性试验设计时需要特别关注候选分子特性、动物种属的选择、试验剂量的设置、替代分子的必要性、分组和给药方案、药效学指标和暴露评估等。
▶ 种属选择 —— 案例和启发
种属选择的基本原则是,在 PK、代谢、对毒性的敏感性和药理学作用方面代表人类,其中首先应考虑受试物在啮齿类动物和/或兔中是否具有药理学活性。表 1 对已上市 ONTs 生殖发育毒性试验类型和所用动物种属进行了汇总。
Inotersen、Volanesorsen、Patisiran 和Vutrisiran 的相关种属仅为猴,均采用啮齿类动物开展了临床分子和/或替代分子的 FEED 和 PPND 试验;
除因适应症和用药人群仅为男性的产品外,其他已上市 ONTs 同时采用啮齿类和兔开展 EFD 试验。
兔 EFD 试验均采用了临床分子,主要目的可能在于用临床分子在第二个种属中考察因脱靶效应带来的生殖毒性。
考虑到杜氏肌营养不良症(DMD)患者主要为男性,Eteplirsen、Golodirsen 一般毒理学重复给药中均未观察到对雄性生殖系统的影响,故均未开展 DART 试验。
Viltolarsen 和 Casimersen 的适应症也为 DMD,前者仅进行了雄性小鼠的 FEED 试验,后者则是伴随在重复给药毒性试验中进行了考察。
表1 已上市 ONTs DART 试验类型和动物种属汇总
左右滑动查看
注:”a”药理学活性相关种属;“-”表示未开展或资料中未披露;未单独标注供试品的,均采用的是临床分子;“Lead+Sur.”表示临床分子和替代分子;“Seg1+2 “表示生殖I、II段联合试验。
◆ 啮齿类动物和/或兔中具有药理学活性的情形
进行标准的啮齿类和兔研究,参考常规小分子化药的设计。
受试物仅在用于 EFD 研究的一个常规种属(大鼠或兔)中有活性的情况下,需在第二个种属的 EFD 研究中评估与 ONTs 脱靶效应相关的影响(如Givosiran、Inclisiran、Lumasiran均用了无药理学活性的兔作为第二个种属来考察 EFD 毒性)。
◆ 在啮齿类和兔中均无药理学活性,仅猴是相关种属的情形
进行常规种属(啮齿类动物或兔)的生殖发育毒性研究是有价值的,同时设置替代分子考察与预期药理学相关的生殖毒性。如 Eplontersen 药理相关种属为猴,仅采用小鼠进行了临床分子和替代分子的 I-II 段联合试验,均未见毒性表现。可见亲代雌雄动物 Unconjugated eplontersen 水平于肝脏的累积增加,但在胎盘和胎仔肝脏中未检测到。替代分子可引起肝脏 TTR mRNA 水平显著下降,血清中正常胚胎发育所必需的维生素 a 水平下降,为临床提供风险提示。
当研究的目的是确定某种生殖毒物的特征时,如,在有特定生殖风险的 RNA 靶点(无法在啮齿类动物中解决)或基于一般毒性研究中的独特结果的情况下,可能需要在 NHPs 中评估生殖发育毒性[16]。
◆ 无任何相关种属 (如抗微生物 ONTs)
进行常规种属(啮齿类动物或兔)的生殖发育毒性研究,参考小分子化药。如有条件设计替代分子,同时需要采用替代分子在生殖毒性预试验和/或正式试验中,评估药理作用相关的生殖毒性风险。
▶ 剂量选择
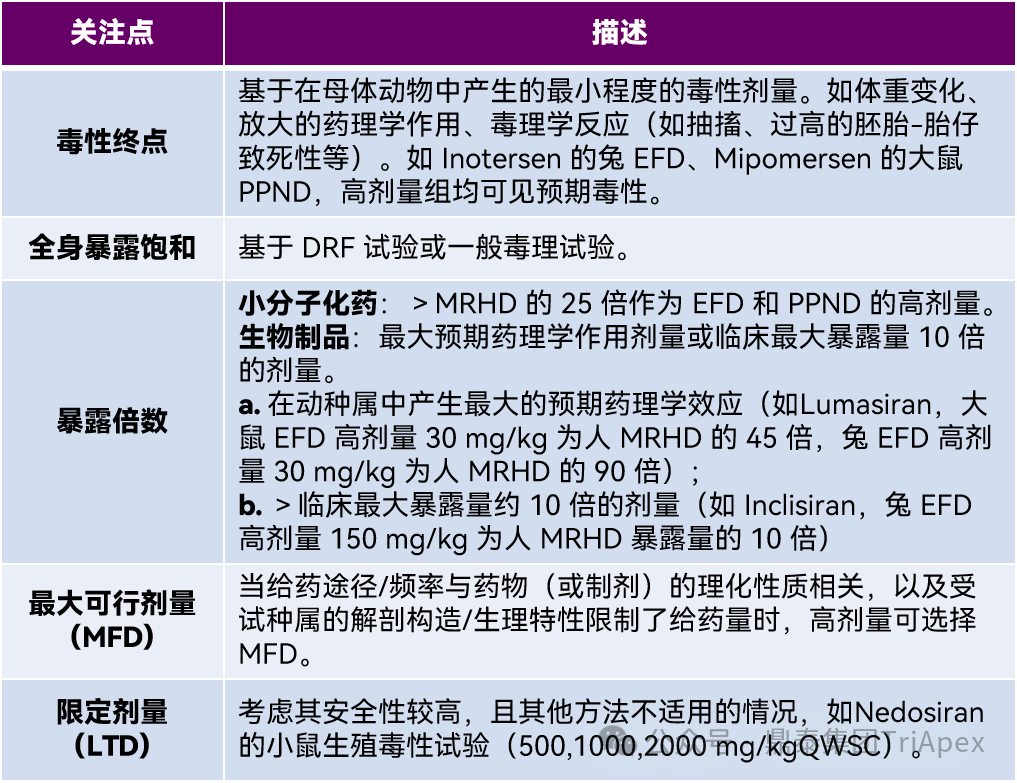
◆ 高剂量组的设置
表2 高剂量组设置的考虑因素
◆ 低剂量组的设置
预期观察到生殖发育毒性的未见不良反应剂量(NOAEL) ,低剂量通常应为 MRHD 人体暴露的较低倍数(如 1-5 倍)。如在 Mipomersen 的小鼠 I 段和 II 段试验、兔 II 段试验中,在 MRHD 2 倍和 5 倍暴露量下,未见生育力和胚胎-胎仔毒性。
▶ 替代分子的设计与分组
如果替代分子在单剂量水平就观察到对生殖功能的影响,可能需要进一步确定与药理学相关的生殖效应的剂量-反应关系,获得 NOAEL。在这种情况下,可能仅在最高剂量水平对临床分子进行毒性考察。这一策略适用于采用安全性已知的替代分子,因其化学结构相关的生殖毒性潜力已被充分评估。如 2019-Volanesorsen 首先设置低剂量的替代分子组,因未观察到生殖功能相关异常,为了进一步考察生殖毒性和剂量效应关系,又开展了中、高剂量的替代分子试验,最终确定 NOAEL 为低剂量。
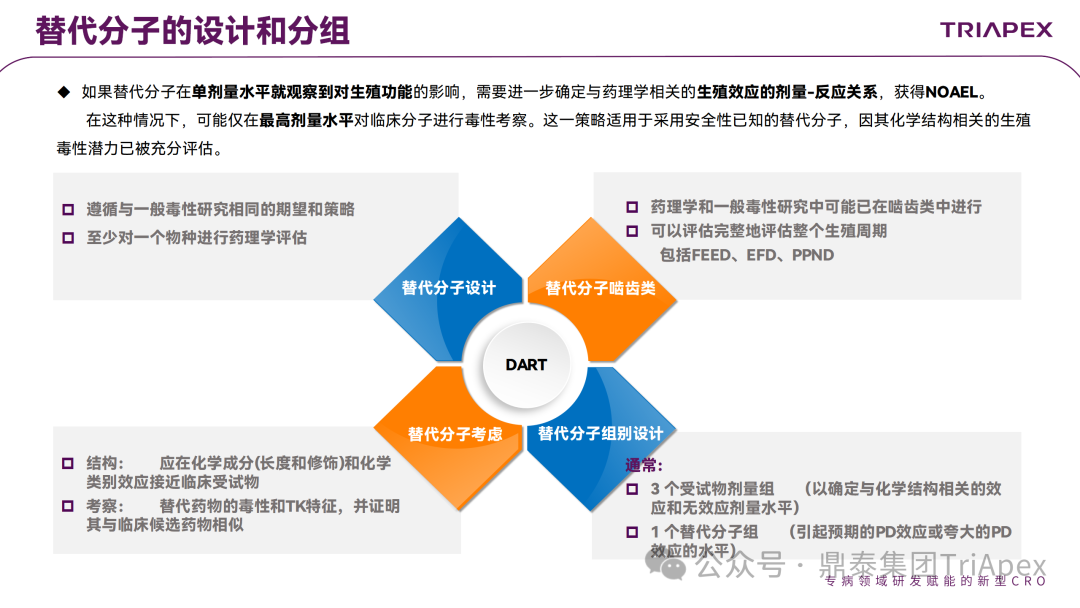
图6 生殖发育毒性试验种替代分子组的设计
▶ 给药方案
ONTs 药物的血浆半衰期短,组织半衰期和 PD 半衰期往往很长,临床给药频率较低(每周给药或更长),因此生殖发育毒性试验的给药频率需要具体考虑,而不是参照临床给药方案。如 Vutrisiran,临床给药频率为 Q3M,已经证明肝、肾可以将药物完全清除,所以提高了给药频率(大鼠生殖毒性试验给药频率为 QD 或 QW)以确保子代离乳前的关键发育期有足够的持续性母体和胎盘暴露。
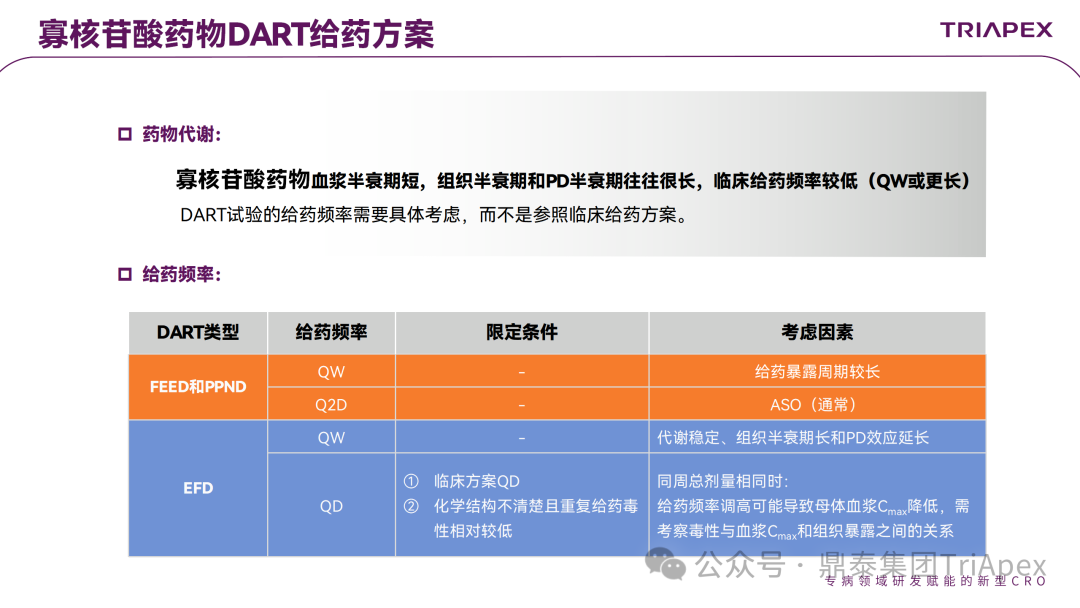
图7 生殖发育毒性试验中给药方案的考虑
▶ 药效学生物标志物考察
如果已在前期试验中考察了对药效学生物标志物的影响,则不再需要在生殖发育毒性试验中进行药效学生物标志物检测(如 Lumasiran,在猴重复给药显示 HAO1 mRNA 的剂量反应性沉默,QM 4 mg/kg 或 QW 2 mg/kg 沉默率高达 99% );使用替代分子时,建议考察 PD 指标,以及相关基因沉默或蛋白表达已知是否引起其他的蛋白改变。如 Mipomersen 在 EFD 中评估了临床分子和替代分子对 LDL/VLDL 水平的影响(但实际均未降低 LDL/VLDL 水平)。
▶ 暴露评估
研究表明[9,17],胎盘转移不良,胎盘中检测到的浓度一般较低,胎儿暴露的浓度也低于可检测到的浓度。因此,类似的结构和化学亚类在组织中的药理作用预计很低甚至不存在。由于 PK 特性通常与序列无关,可能不需要对所有类别的分子进行暴露量检测,或者可能仅需要对某一特定化学类别进行初步检测[4]。
ONTs 血浆代谢快,组织半衰期长,主要分布与肝脏和肾脏。如果已经有来自同一种属其他研究的数据,则可能不需要详细评估血浆浓度与 AUC。建议检测母体靶器官组织浓度,评估胎盘或胎仔组织中的浓度(如Mipomersen、Nusinersen、Volanesorsen等)。
根据 ICH S5(R3)指南,评估时需确认妊娠状态下的暴露水平,必要时,测定胚胎或胎仔的药物浓度,或采集乳汁或检测离乳前子代的暴露。如 Inclisiran、Givosiran、Patisiran 等。
此外,还需考虑评估非预期的免疫刺激作用的潜在影响,如用 TLR3、7 或 8 激动剂给与妊娠小鼠后,可引起妊娠依赖性高血压和类似子痫前期的母体变化[18,19]。
综上,科学的设计和母体评估是 ONTs 生殖发育毒性研究的重要考虑点。
已上市寡核苷酸药物
生殖发育毒性研究案例概述及启示
鼎泰集团系统调研了美国食品药品监督管理局(FDA)及欧洲药品管理局(EMA)批准的 ASO、siRNA、适配体等药物的研究案例,并汇总了其主要生殖发育毒性表现(因篇幅原因,在本文中未发布)。从中得到很多有益于后期试验设计的启示:
种属选择
siRNA 的生殖毒性试验通常采用啮齿类(大鼠和小鼠)和兔(仅EFD)。当相关种属仅为 NHPs 时,大多使用了替代分子来进行相关毒性风险的评估;暂未见采用 NHPs 进行生殖发育毒性的报道。
给药频率
剂量设置
毒性解读
基于 ONTs 的胎盘转运效率和生物学效应,EFD 试验结果与之相匹配;
基于其免疫激活等作用,会产生一定的生殖发育毒性;
替代分子的毒性结果,可为临床生殖发育毒性风险提供一定的参考。
基于上述调研和理解,本机构已完成了多套ONTs产品的生殖发育毒性评价,积累了丰富的经验。期望与更多客户深度合作,为我国ONTs的研究提供助力。
鼎泰集团寡核苷酸药物
及生殖发育毒性研究平台简介
▶ 经验丰富的多种属生殖发育毒性试验经验积累
鼎泰集团致力于为 ONTs 的开发提供多种属(大鼠、小鼠、家兔、食蟹猴等)生殖和发育毒理学综合服务。
我们在雌雄动物生育力与早期胚胎发育毒性试验(FEED)、胚胎-胎仔发育毒性试验(EFD)、围产期发育毒性试验(PPND)、增强的围产期发育毒性试验( ePPND )及各阶段联合试验方面积累了丰富的经验。这些研究可充分评估受试物对整个生殖周期的潜在影响,并进行功能评估,包括神经行为测试和子代发育情况等。

▶ 技能扎实、高效匹配研究目的生物分析平台
鼎泰集团拥有 6 大分析平台(免疫分析平台、细胞分析技术平台、qPCR平台、LC-MS/MS及LC-HRM分析平台、超灵敏分析平台、多因子检测平台),能够满足 siRNA 双链或 AS 高灵敏度生物分析、免疫激活相关指标监测的需求。此外,我们已建立了丰富的生物样本库,为 ONTs 生殖发育毒性试验中可能涉及的生物分析(包括暴露量评估、药效学生物标志物检测)提供客观、科学的检测数据。
结语
ONTs 的生殖发育毒性可能受多重因素的影响,如化学修饰、胎盘转运效率、药理学活性、母体毒性等。因此,客观评估 ONTs 的生殖发育毒性,需要结合产品特点进行科学的试验设计和综合分析。目前尚无针对 ONTs 生殖发育毒性研究的指导原则。已上市产品的生殖发育毒性研究设计和结果较好地支持了其在目标人群中临床试验的开展,也为新的 ONTs 生殖发育毒性试验的开展提供了宝贵的参考经验。鼎泰集团在深度汇总和理解已上市药物生殖发育毒性案例、行业白皮书的基础上,根据国外监管机构和寡核苷酸安全工作组(OSWG)发布的相关建议和共识文件,积累了丰富的项目实战经验,期待为客户提供更高质量的服务。
参考资料:


































































































































