


当11岁的Kesten Anderson成为 AK-OTOF-101 试验的首位受试者,他的母亲在知情同意书上签下名字的那一刻,这场“听觉革命”已然超越科学范畴,成为人类对抗遗传病命运的集体叙事。正值2025年国际爱耳日,鼎泰团队将 AK-OTOF 的故事记录下来,不仅是对科学进步的致敬,更是对无数家庭重燃听力希望的坚定承诺。也激励着我们每一个人在助力创新转化之路上勇毅前行……
前言
听力障碍是世界上发生率最高的感官缺陷性疾病。根据世界卫生组织发布的全球听力报告显示,全球患有听力损失的人群超 4.3 亿。基因突变是引起耳聋的重要原因之一,约占 60% 左右。遗传性耳聋多由单基因突变引起。通过基因治疗,将外源基因导入靶细胞,以补偿或纠正发生突变的基因,可以达到治疗遗传性耳聋的目的,是一种有前景的治疗策略。目前,遗传性耳聋基因治疗的策略主要以基因替代和基因编辑为主[1]。根据遗传性疾病的遗传类型和致病机制,不同致病机制的基因突变应选用合适的基因治疗策略。隐性遗传病主要是由两个等位基因的功能缺失(loss-of-function, LOF)引起;显性遗传病更为复杂,有三种主要的分子机制:
1)单倍剂量不足,指的是一个等位基因的功能缺失,但另一个等位基因不足以维持基因的功能;
2)显性负(dominant-negative,DN)效应,即突变等位基因不仅无功能,而且干扰正常等位基因产物的功能;
3)功能获得(gain of function,GOF),指的是致病性等位基因基因产物剂量或活性增加。
不同的基因治疗策略有着不同的工作方式:
1)基因替代策略,是通过递送正常基因以提供充足的有功能蛋白,适用于隐性遗传病和单倍剂量不足的显性遗传病;
2)基因抑制策略,是通过反义寡核苷酸(ASO)或 RNA 干扰(RNAi)技术在 mRNA 水平抑制突变基因表达,该方法可用于 DN 和 GOF 导致的显性遗传性疾病;
3)基因编辑策略,主要包括 CRISPR/Cas9 核酸酶非同源末端连接(NHEJ)修复方式介导的基因敲除(gene disruption)策略,通过敲除突变基因,可应用于 DN 和 GOF 导致的显性遗传性疾病;以及 CRISPR/Cas9 介导的同源重组修复(HDR)、碱基编辑器和先导编辑器介导的基因修复(gene correction)策略,可直接纠正基因突变位点,因此显性、隐性遗传性疾病均适用[2]。
目前,已有超过 40 项研究利用 AAV 载体介导的基因治疗成功恢复了 20 余种遗传性耳聋动物模型的听力。虽尚未有耳聋相关基因治疗药物被批准上市,但在临床研究领域,已有部分药物获批进入临床试验,逐渐开始产生和积累人体数据。Clinicaltrials.gov 以及中国临床试验注册中心先后登记了 5 项关于治疗 OTOF 突变引起的听神经病的临床试验,其中 4 项是采用 AAV 载体递送全长 OTOF 的方法,1 项是采用 RNA 编辑工具修复基因突变。欧洲也登记了 1 项由 Sensorion 公司发起的利用 AAV 递送全长 OTOF 治疗听神经病的临床试验。在以上登记的临床试验中,有 3 款药物展现出了令人欣喜的试验结果,分别是AK-OTOF(Akouos)、OTOF-GT(Sensorion)、DB-OTO(Decibel Therapeutics)。本期推文将聚焦第一款具有里程碑意义的候选药物 —— AK-OTOF,系统梳理其非临床至临床的开发逻辑,探讨基因治疗药物非临床评价的底层逻辑与创新方向。
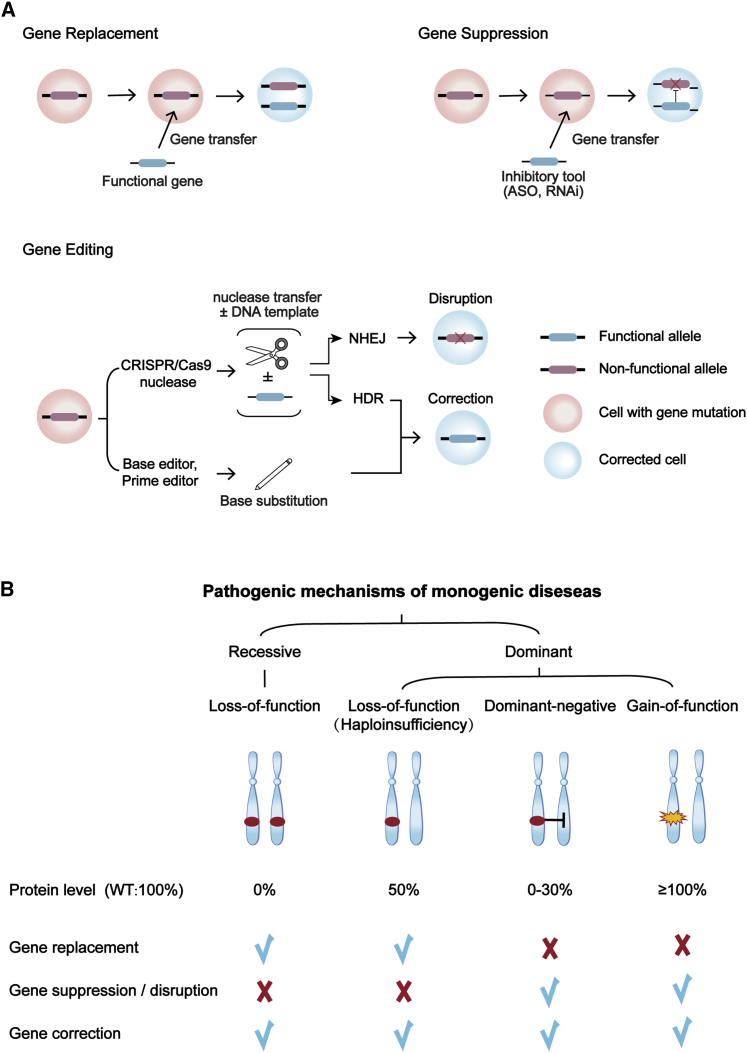
图1. 单基因疾病的基因治疗策略[2]
★ 文章导览★
滑动查看
AK-OTOF 非临床研究设计
1.1
结构及作用机制
2022年9月13日,美国 FDA 的一纸批文点燃了全球耳科医学界的希望——生物制药公司 Akouos 宣布,其基因治疗产品 AK-OTOF 获准进入临床试验。这不仅意味着全球首个针对遗传性耳聋的基因疗法正式迈向临床,更标志着人类首次通过 AAV 载体直接修复内耳功能,为 20,000 名因 OTOF 基因突变致聋的患者推开了一扇“听见世界”的大门。AK-OTOF 是一款双载体 AAVAnc80 药物,2022年10月,礼来公司斥资约 6.1 亿美元收购了 Akouos,以加速其听力基因疗法的开发进程。AK-OTOF 产品利用了 AAVAnc80 这种对耳蜗毛细胞(IHCs)具有高转导效率的衣壳,分别包装近6kb的人类 cDNA,并递送至内毛细胞中,以替代突变的基因,从而恢复内耳细胞的功能[3]。
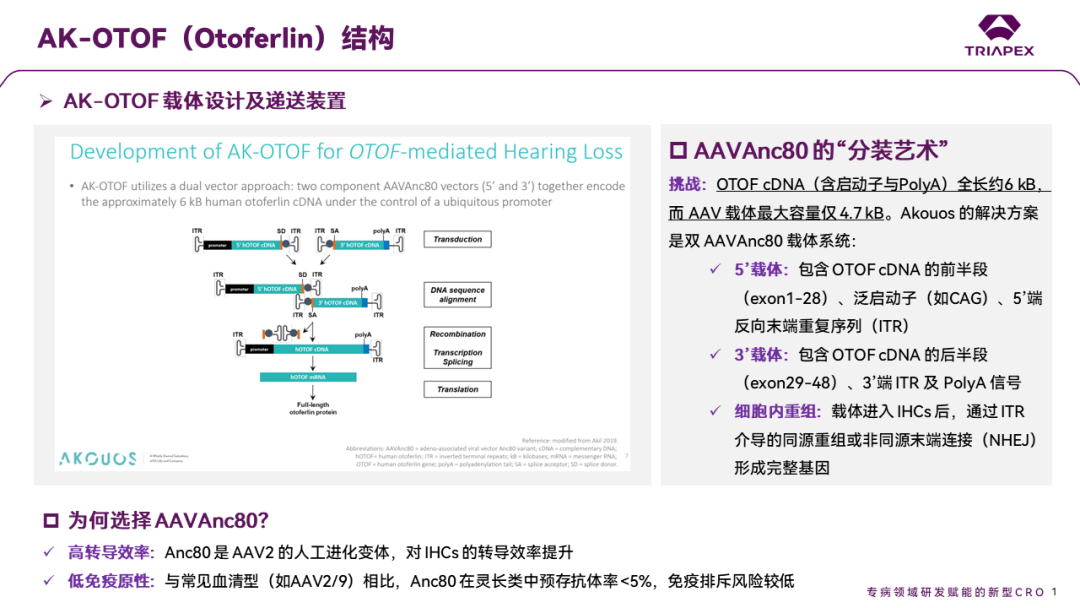
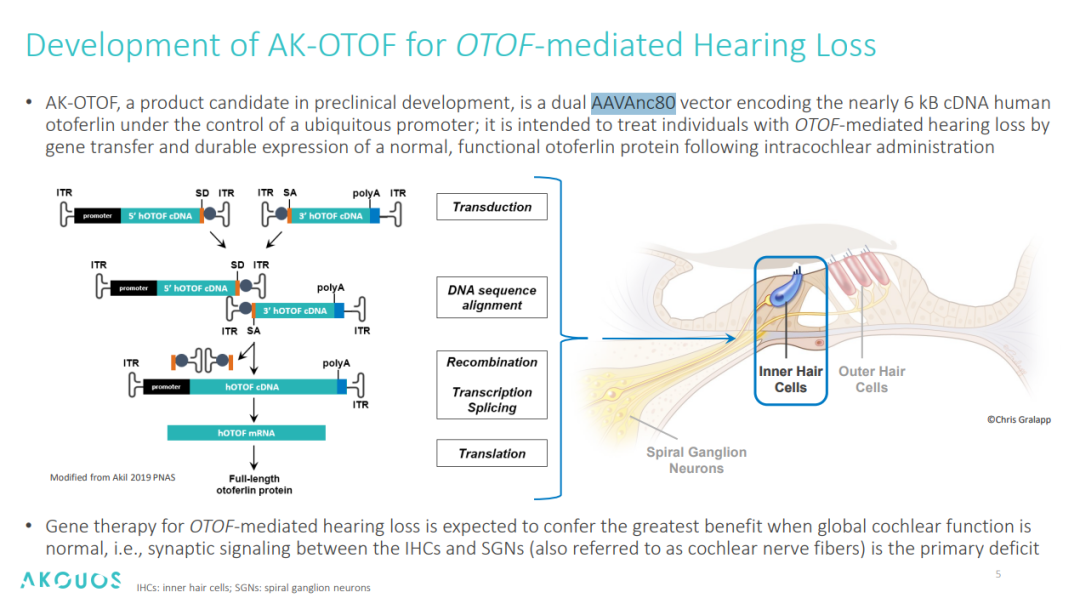
图2. AK-OTOF 作用机制和设计思路[3]
1.2
非临床研究设计及部分研究结果
2024年1月23日,Akouos 宣布了 1/2 期 AK-OTOF 研究的积极初步临床结果,其临床试验快速推进,取得积极成果的背后是非临床研究的严谨验证与临床策略的大胆创新。接下来,本文将聚焦非临床研究的关键数据与儿科临床试验的设计逻辑,深度解析这一突破性疗法如何从动物模型走向人类患者,为 OTOF 突变致聋的儿童重燃“听见世界”的希望。
1.2.1 非临床药效学研究
试验设计:
首先通过 CRISPR-Cas9 技术敲除小鼠 Otof 基因 exon7,构建 Otof 基因敲除小鼠(Otof⁻/⁻)模型,模拟人类 OTOF 无义突变,导致耳蜗内毛细胞无法释放神经递质,表现为听觉脑干反应(ABR)完全缺失,致聋小鼠。随后通过单侧耳蜗注射给药,将 AK-OTOF 注入小鼠耳蜗,并设置生理盐水对照组,1×(基准剂量)、2.5×、5×剂量组,探索 AK-OTOF 的药效学效应及剂量-反应关系。
研究结果:
首先是功能蛋白表达方面,免疫荧光的结果显示,3周龄小鼠单侧耳蜗注射 AK-OTOF(5×剂量)后,70% IHCs 在1个月内表达全长人源Otoferlin,且表达持续≥6个月。
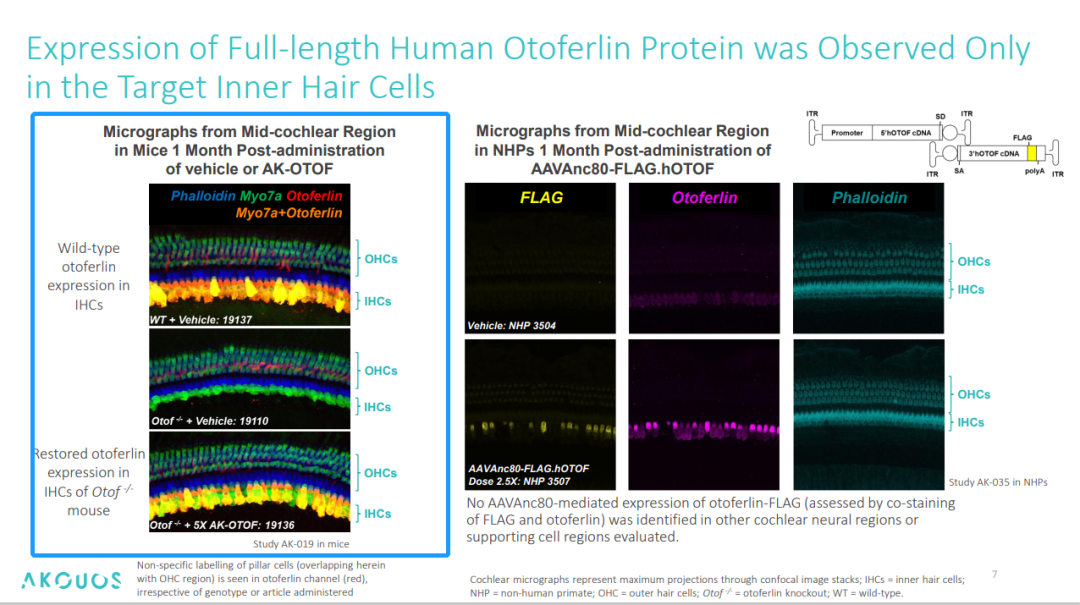
图3. 野生型小鼠与基因编辑小鼠 IHCs 细胞蛋白表达荧光图像[4]
在听觉功能恢复方面,AK-OTOF 在基因缺陷幼龄小鼠上也表现出了积极的结果。经 AK-OTOF 治疗的Otof⁻/⁻小鼠 ABR(听觉脑干反应)阈值从>100 dB SPL(Sound Pressure Level)恢复至 20-30 dB SPL(最快15天),这一数值与野生型小鼠相当。该结果意味着 AK-OTOF 重建了小鼠的听觉功能,且80%的小鼠在6个月后仍保持正常的ABR阈值,证实 AK-OTOF 基因表达的长期稳定性。同时,非临床数据显示5X剂量组疗效显著优于1X(P<0.01),也提示了一定的剂量反应关系。
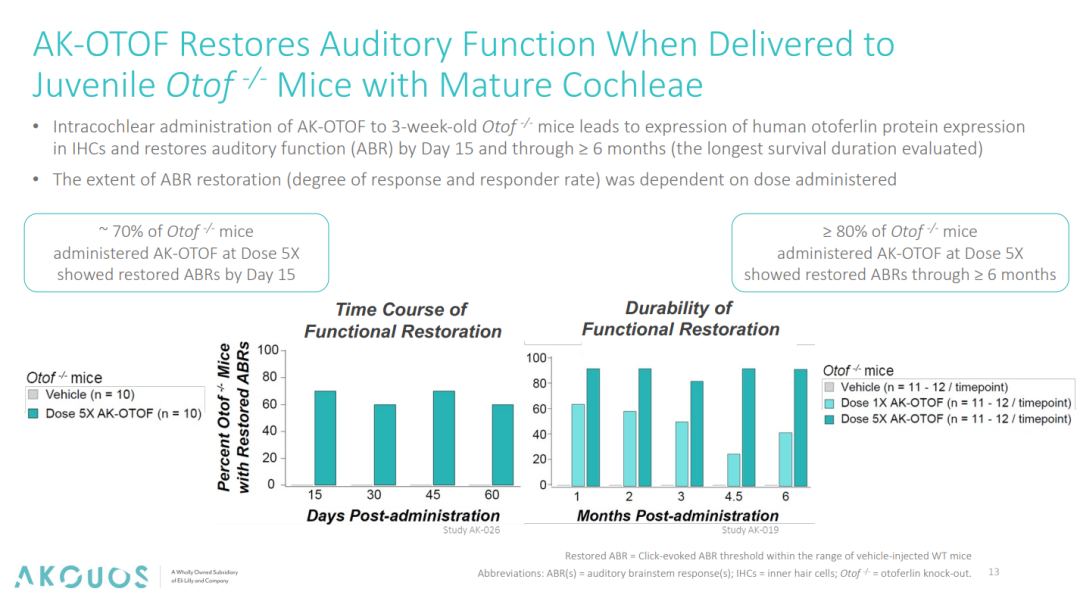
图4. AK-OTOF 恢复基因编辑小鼠听觉功能[4]
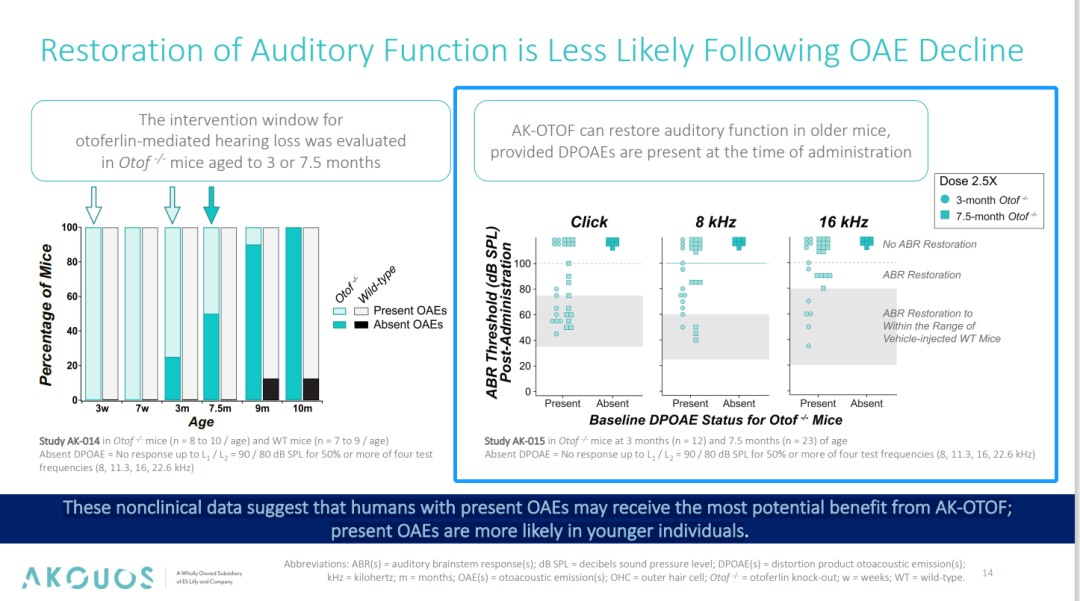
图5. AK-OTOF 对基因编辑小鼠 ABR 阈值的影响[4]
同时,我们注意到在耳声发射(OAEs:耳蜗内毛细胞功能的指标,Otof⁻/⁻小鼠在听力丧失前会经历 OAEs 的下降)下降之前,在Otof⁻/⁻小鼠耳蜗内给予 AK-OTOF,可恢复听觉功能,这一结果提示如果 AK-OTOF 在 OAEs 下降前(即听力损失的早期阶段)进行干预,可通过预防耳蜗细胞功能退化实现更有效的治疗,同时也可能为后续临床受试者人群的选择及治疗窗口的把握给出建议。
1.2.2 非临床安全性研究
试验设计:
评价 AK-OTOF 在啮齿类及非啮齿类中的局部及系统毒性。
幼龄食蟹猴:供试品组双侧耳蜗注射 AK-OTOF(剂量2.5X、5X、9X、15X),对照组注射AAV空载体。安全性评价指标包括听觉/耳蜗功能(ABRs 及 DPOAEs)、组织病理学检查(包括耳蜗和脑组织)、脏器重量、临床病理检查(血液学、血清生化、凝血常规及尿常规),同时伴随生物分布与病毒脱落的考察。
3周龄 Otof⁻/⁻ 小鼠:供试品组单侧耳蜗注射 AK-OTOF(剂量1X、2.25X、5X),对照组注射 AAV 空载体。安全性评价指标包括听觉/耳蜗功能(ABRs 及 DPOAEs)、组织病理学检查(包括耳蜗和脑组织)、脏器重量,未开展临床病理检查。
研究结果:
局部耐受性(对听觉/耳蜗功能的影响):在 6 个月的毒性考察周期内,未观察到各剂量水平的 AK-OTOF 对食蟹猴 ABR 阈值的影响,且食蟹猴耳蜗内毛细胞存活率>98%,无炎症或纤维化现象的出现[3]。总体来看,未观察到 AK-OTOF 对听觉/耳蜗功能的影响,展示出了较好的局部耐受性。
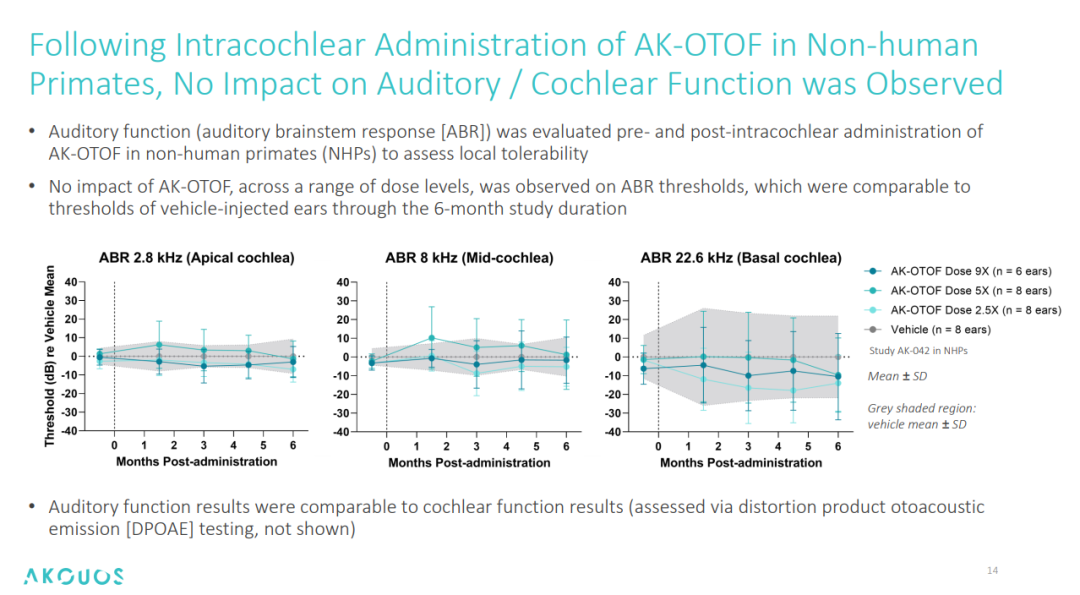
图6. AK-OTOF 对食蟹猴听觉/耳蜗功能的影响[4]
生物分布及病毒脱落:利用标记载体(AAVAnc80-FLAG.hOTOF)在食蟹猴中区分载体介导与内源性耳蜗中 otoferlin 蛋白的表达(WB),并同时用于评估非靶组织中蛋白的表达。结果显示,仅在耳蜗内毛细胞 IHCs 检测到 FLAG 信号,且在第 6 个月依然能检测到载体序列的存在;外毛细胞、螺旋神经节细胞 FLAG 信号均呈阴性,提示了 AK-OTOF 的靶向性高,存续时间长。在非靶组织中,肝脏、脾脏中检出微量载体 DNA,但未检测到 Otoferlin 功能性蛋白的表达(Western blot),且肝脏、脾脏中的载体拷贝数在 1 个月后降至<10 copies/μg DNA,6 个月后基本降到基线水平。在病毒脱落方面,血清、全血、尿液和唾液及鼻拭子样本中,AAV 载体在给药后约3至4周内清除,在药后第 3 天,大约 70% 的耳拭子样本中检测到 AAV 载体序列,第3个月时在约 20% 的耳拭子中仍可检测到,3 个月之后转阴。
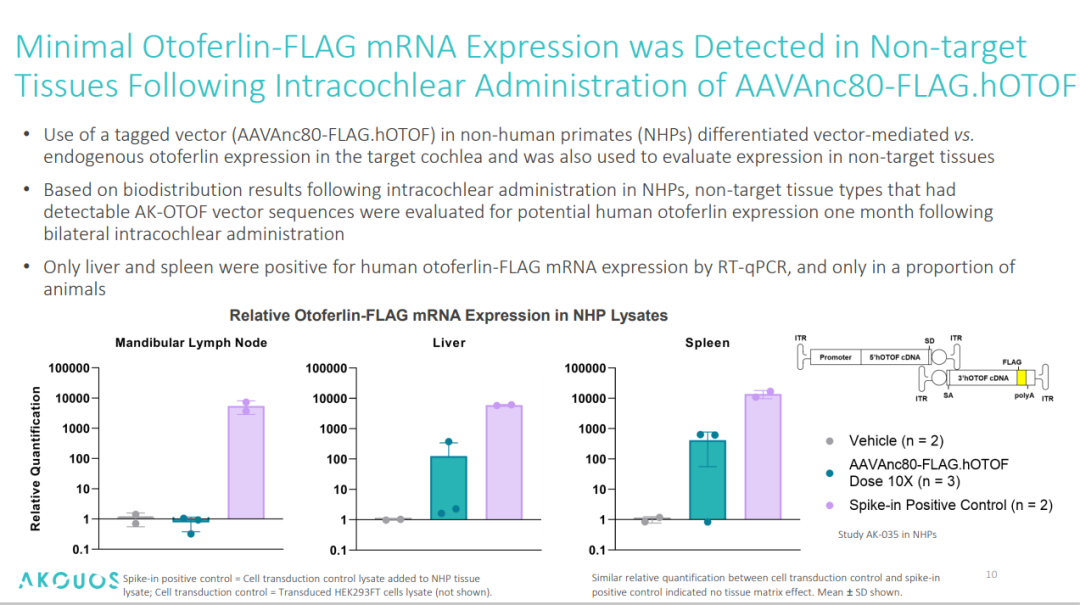
图7. AK-OTOF 生物分布研究[4]

图8. AK-OTOF 病毒脱落研究[4]
安全性评价:在其它一般毒理评价指标中,耳蜗内给予 AK-OTOF 后,6 个月的毒性考察周期内没有观察到对食蟹猴及小鼠全身组织病理或临床病理、听觉的影响。

图9. AK-OTOF 非临床安全性研究结果[3]
综上,在食蟹猴和小鼠中,耳蜗内给药局部和全身耐受性良好,初步提示 AK-OTOF 具有较高的安全性。非临床研究所显示的“靶向性、持久性、安全性”构筑了 FDA 批准临床试验的科学基石。
AK-OTOF 临床研究布局
2022年9月,FDA 批准 Akouos 针对 AK-OTOF 提交的 IND 申请,允许开展首个针对遗传性听力损失的基因疗法临床试验,也是首个 AAV 载体直接递送至内耳的儿科试验。
2.1
Ⅰ/Ⅱ 期临床试验设计(NCT05821959)

图10. AK-OTOF 1/2期临床试验设计
AK-OTOF-101临床试验(NCT05821959)是一项1/2期试验,旨在评估通过 Akouos 递送装置给予递增剂量的AK-OTOF的安全性、耐受性和有效性。
阶段:Phase 1/2无缝设计,兼顾安全性探索与疗效验证。
人群:OTOF双等位突变儿童,年龄≥2岁,ABR 缺失但 OAE 存在。
Part A:
队列1a:n=2,7-17岁,剂量水平1(4.1E11 total vg/cochlea)
队列1b:n=6,2岁以上,剂量水平1(4.1E11 total vg/cochlea)
Part B:
队列2:n=6,2岁以上,剂量水平2(8.1E11 total vg/cochlea)

图11. AK-OTOF 1/2期临床试验主要入排标准

图12. AK-OTOF 1/2期临床试验临床终点
2.2
当前研究结果
2024年1月23日,礼来公司的全资子公司Akouos 宣布了 AK-OTOF-101 研究的1/2期初步临床结果。该研究表明,第一位参与者(具有10多年重度听力损失史的个体)在给药 AK-OTOF 后 30 天内恢复听力!该受试者是一名11岁儿童,在接受 AK-OTOF 治疗前患有先天性严重听力损失,单次给药后 30 天内,ABR 阈值从无法检测恢复至65-20分贝(正常范围为≤20分贝),部分频率达到正常水平,即患者获得了听力功能的改善和恢复,可在不依赖人工耳蜗的情况下感知声音并做出反应;同时,在安全性方面,未报告严重不良事件,手术及药物耐受性良好。
据报道,Akouos 可能在耳鼻喉科研究协会(ARO)2024 Presidential Symposium 或 2025 MidWinter Meeting 会议公布第2例患者的数据。若后续试验验证了 AK-OTOF 的安全性和有效性,可能扩展至其他内耳疾病治疗,遗憾的是,笔者暂未查询到 AK-OTOF 第2例患者的临床数据,但是2025年2月25日,再生元(Regeneron)公布了其基因疗法 DB-OTO 的1/2期数据,DB-OTO 也是针对遗传性耳聋开发的一款双载体 AAV 基因治疗产品,由再生元于收购其长期开发合作伙伴 Decibel Therapeutics 所得,与 AK-OTOF 的作用机制类似,DB-OTO 也通过将 OTOF cDNA 分段包装于两个 AAV 载体中,以解决因 OTOF 基因过大而超出单个 AAV 载体载荷的问题。
再生元公布的数据显示,在1/2期试验中,12 名儿童接受了 DB-OTO 治疗,其中 9 名患者的接受了单侧 DB-OTO 耳蜗注射的治疗,另外 3 名患者(约 1 岁)则接受了双侧耳蜗注射的治疗,本次更新的内容主要包括给药后 72 周观察的结果,具体如下:
在进行过至少一次治疗的患者中,有 10 名在不同分贝水平上表现出显著的听力改善。
在接受 24 周评估的 5 名儿童中,3 名儿童的听力有所改善,达到 “接近正常”或“正常”水平。
从长期数据来看,第一位接受给药的 10 个月大的患者,在 72 周时展现出言语和发育进展。根据正式的语音感知评估,该儿童能够在没有视觉线索的情况下,在对话层面正确识别日常单词。该患者在基线时基本处于耳聋状态,一只耳朵接受 DB-OTO 治疗后,几周内就开始对声音做出反应,六个月内能够听到某些耳语,48 周的评估表明保持了“非常好的听力敏感性”。
在安全性方面,所有 12 例患者对 DB-OTO 均耐受性良好,无 DB-OTO 相关 AE 和 SAE。但有 5 例患者经历手术后短时出现前庭功能不良反应(如眼球震颤、恶心、头晕、呕吐),在给药后 6 天内恢复,以上结果也初步证实了 DB-OTO 的安全性和有效性。
当前 AK-OTOF 及 DB-OTO 的积极性结果为全球约 20 万 OTOF 突变患者提供了一次性治愈可能,有望帮助他们摆脱传统的助听器或人工耳蜗,也能够推动基因疗法在感觉神经系统疾病中的应用,为其他遗传性耳聋类型(如 GJB2 突变)提供技术参考。但仍应注意到该类产品的长期安全性和技术复杂性,双载体递送和精准耳蜗给药对手术操作要求极高,也需要持续监测基因表达稳定性和免疫反应等风险。总之,创新的双 AAV 载体递送和精准耳蜗给药技术,展现了基因疗法在遗传性耳聋治疗中的潜力。早期临床数据显示其安全有效,未来需进一步验证长期疗效及扩大适应症。
AK-OTOF 非临床研究的临床转化价值
通过以上非临床及临床研发路径的梳理和总结,总体来说,非临床研究为临床研究提供了疗效验证、安全性保障、剂量选择等多方面的支持,AK-OTOF 临床策略的大胆创新,离不开非临床研究数据的缜密性与完整性,为 AK-OTOF 的临床研究提供了全方位科学支持。
3.1
疗效验证与机制支持
靶向性验证
非临床研究通过Otof⁻/⁻小鼠和灵长类(NHPs)模型证实,AK-OTOF 能够特异性表达于IHCs,未在外毛细胞、螺旋神经节或其他非靶组织中检测到功能性蛋白。这提示临床研究可聚焦 IHCs 功能恢复作为核心疗效指标。
持久性证据
在药效学研究中,小鼠中单次给药后疗效持续≥6个月,且食蟹猴生物分布数据也提示耳蜗内载体 DNA 长期存在,支持短周期的临床研究设计单次给药方案。
3.2
安全性保障
局部耐受性
在毒理学研究中,食蟹猴中耳蜗毛细胞存活率>98%,无炎症或纤维化,证实手术递送方式的安全性,为临床选择微创经外耳道入路提供依据。
系统安全性
NHPs及小鼠中中血液生化、肝肾功能、脑组织病理均无异常,且生物分布数据提示非靶组织(肝脏、脾脏)中AAV载体快速清除,提供了疗效和安全性数据,可能减少临床研究中对全身毒性的担忧。
3.3
剂量选择与优化
剂量反应曲线
小鼠实验中,5X剂量组疗效显著优于1X(P<0.01),但高于5X剂量组后疗效是否会出现平台期还未尝可知,提示临床需探索最佳剂量区间(如2.5X-5X),避免无效或过度治疗。
剂量换算逻辑
基于内耳体积(人类耳蜗≈80 μL,小鼠≈1 μL)进行跨种属剂量换算,保留 10 倍安全边际,为临床起始剂量提供科学依据。
3.4
干预窗口与人群选择
OAE 动态变化
动物数据显示,OAE 存在时(小鼠<3月龄,人类<11岁)治疗可最大化疗效,支持临床入组OAE 阳性儿童(2-11岁),锁定最佳治疗干预窗口。
基因型-表型关联
非临床研究聚焦双等位 OTOF 致病突变,提示临床需严格筛选突变患者,确保目标人群同质性。
FDA 的“绿色通道”—— AK-OTOF 孤儿药认定与儿科试验的监管逻辑
通常,监管机构如 FDA 在审批临床试验申请时,一般要求先在成人中开展临床试验,积累过一定的人体数据之后,再逐步外推到儿童,尤其是对于新药。但对于 AK-OTOF 来说,FDA 为何会支持直接在儿童群体中开展临床研究?其背后不仅体现了 Akouos 对产品开发科学性的严格把控,更离不开对监管策略的灵活运用,以加速其儿科适应症的开发。
4.1
孤儿药认定与罕见儿科病的双重加持
孤儿药认定(ODD):基于 OTOF 耳聋在美国的患病率<20万,AK-OTOF 获得孤儿药认证,Akouos 获得 7 年市场独占权、50%临床试验税收抵免及 FDA 全程指导。
罕见儿科病(RPDD):允许在无成人数据时优先开展儿科试验,尤其适用于无替代疗法的严重疾病。AK-OTOF 于2021年斩获两项认定(早于 IND 批准时间),为儿科试验铺平道路。
4.2
为何跳过成人直接入组儿童?
科学依据
神经可塑性窗口:听觉皮层发育关键期为0-3岁,延迟治疗可能导致语言功能永久损伤;同时,非临床数据显示,OAE 存在时(通常<11岁)治疗可最大化疗效。
未满足的医疗需求与疾病特殊性:患者群体主要为儿童,早期干预对听觉神经发育至关重要。
非临床数据的充分支持:非临床数据充分证明了 AK-OTOFA 在幼龄动物中的靶向性、有效性及安全性。
监管策略
动物规则:FDA 对罕见病和儿科适应症采用灵活审评策略,允许基于动物数据外推至儿童人群。FDA 21 CFR 314.600法规也允许在无法进行成人试验时,基于充分动物数据批准儿科适应症。
儿科研究计划(iPSP):Akouos 与 FDA 达成协议,将安全性数据从小鼠/NHPs 外推至儿童,同时承诺长期随访至成年。
知情同意优化:采用可视化工具(如耳蜗模型动画)向儿童家长解释载体机制,并设立独立监察委员会(IDMC)实时监控安全性。
综上所述,该案例体现了 FDA 对罕见病治疗创新的支持,尤其在儿科领域优先考虑患者群体需求与治疗窗口期的特殊性。AK-OTOF 能够在儿童中直接开展临床试验的原因主要有以下几点:
获得 FDA 的 ODD 和 RPDD,加速儿科试验;
OTOF 听力损失主要在儿童中发病,且存在严重未满足的医疗需求;
临床前数据充分支持安全性和有效性,尤其是在动物模型中显示持久恢复。
听见未来 —— 基因疗法的希望之光
AK-OTOF 的非临床研究以“靶向性、持久性、安全性”三大支柱,构筑 了 FDA 放行儿科试验的科学基石;而临床试验的精心设计,则体现了对儿科罕见病患者需求的深刻回应。从 OTOF 基因的碱基对到 FDA 的审评会议,从波士顿实验室的显微操作到非洲村庄的听力筛查,每一步都写满了创新者的执着与患者家庭的期盼。正如 Akouos 创始人 Manny Simons 所言:“我们修复的不只是听力,而是重新连接一个人与世界的对话。”或许在未来某天,基因疗法能让每一个“寂静星球”的孩子,听见花开的声音。
鼎泰集团耳科药物非临床评价平台技术能力
作为耳科药物非临床评价领域的先行者,鼎泰集团依托全流程、多维度的非临床评价技术平台,为全球药企提供精准高效的解决方案。我们以创新药物递送技术为核心,覆盖外耳道给药(外耳道滴液等)、中耳给药(鼓膜注射等)、内耳给药(圆窗膜注射、半规管注射等)等前沿递送方式,突破传统局限,实现精准靶向。借助先进的听力功能检测技术,如ABR、DPOAE、听觉惊跳反射(ASR),以及 CNS 功能评估体系,涵盖运动平衡功能和学习记忆功能等多个维度,鼎泰团队能够精准捕捉药物对听力和中枢神经系统功能的影响。同时,搭配耳科特殊组织病理学、分子病理学检查方法,我们能够从微观层面深入探究药物的作用机制,全面、系统地评估耳科药物的安全性与有效性,为药物研发提供坚实可靠的数据支持。
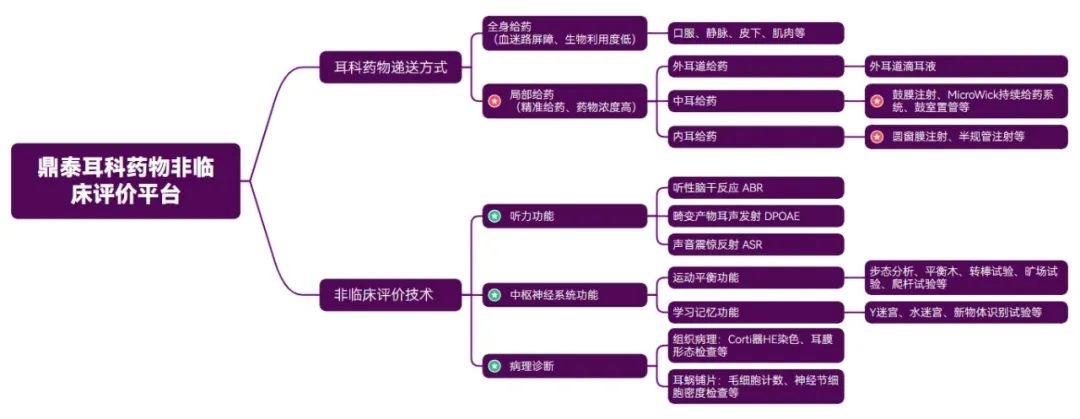
图13. 鼎泰集团耳科药物非临床评价平台
转化科学与药政策略部
毒理II部耳科药物评价团队
参考资料
[1]齐洁玉,谈方志,张李燕,等.遗传性耳聋基因治疗临床指南[J].实用医院临床杂志,2024,21(02):39-44.
[2]Jiang L, Wang D, He Y, Shu Y. Advances in gene therapy hold promise for treating hereditary hearing loss. Mol Ther. 2023;31(4):934-950.
[3]Akouos posters: Preclinical Development of a Genetic Medicine for Otoferlin Gene-mediated Hearing Loss: AK-OTOF.
[4]Akouos posters: Nonclinical In Vivo Expression, Durability of Effect, Biodistribution/Shedding, and Safety Evaluations Support Planned Clinical Development of AK-OTOF (AAVAnc80-hOTOF Vector) for OTOF-mediated Hearing Loss.


































































































































