


TCR-T(T-cell receptor engineered T cells)疗法是一种新型细胞免疫治疗方法,通过对患者的 T 细胞进行改造使其识别并攻击肿瘤细胞。尽管与 CAR-T 相比,TCR-T 的临床转化和上市历程貌似慢了很多,但是由于 TCR-T 不仅能靶向细胞表面抗原,还能靶向细胞内抗原,因此有望改变许多肿瘤(特别是实体瘤)的治疗范式。

Afamitresgene autoleucel(又名afami-cel、ADP-A2M4,商品名为Tecelra®)是由 Adaptimmune LLC 开发的一种 TCR-T 细胞疗法,于 2024 年获得 FDA 批准上市,用于治疗成人 HLA 限制性(HLA-A*02:01P, -A*02:02P, -A*02:03P, 或 -A*02:06P)复发或难治性滑膜肉瘤。
对于晚期不可切除或转移性滑膜肉瘤,标准一线治疗方案包括联合蒽环类药物化疗,Tecelra® 的获批为该类患者提供了一种新的细胞免疫治疗方法。
该疗法的获批是基于 Ⅱ 期临床试验 SPEARHEAD-1(NCT04044768)的结果,是首个获批上市的 TCR-T 细胞疗法。除了 Tecelra® 的获批,FDA 还同时批准了 SeCoreTMCDx HLA 和 MAGE-A4 IHC 1F9 pharmDx 作为滑膜肉瘤患者的诊断工具。
为了充分理解 Tecelra® 的研究过程中与 TCR-T 非临床研究和临床开发相关的思路和经验,本文分别从 MAGE-A4 靶点信息,人类白细胞抗原(HLA)、滑膜肉瘤及现有治疗方法等背景信息入手,梳理了体内外药效试验、抗原的交叉反应和 HLA 的同源异体反应等关键性非临床研究内容。同时,本文还对该产品的上市历程、临床试验设计及结果、受试者选择和伴随诊断等进行了详细分析。期待通过本文为助力该类药物更高效地实现临床转化和推动产品上市提供借鉴和启示。

全文共:8806 字 56 图
预计阅读时长:25 分钟
★ 文章导览★
滑动查看
背景
1
MAGE-A4 靶点
MAGE-A4(MAGE family member A4)基因位于 X 染色体上的癌症-睾丸抗原(Cancer-Testis Antigen, CTA),是 MAGEA 基因家族成员。该家族的成员编码彼此具有 50% 至 80% 序列同源性的蛋白质(NCBI)。在多种类型肿瘤中表达,如黑色素瘤、头颈部鳞状细胞癌、肺癌和乳腺癌,但在除睾丸和胎盘外的正常组织中不表达(UniProt)。
MAGE-A4 作为一种内源性肿瘤抗原,在细胞内生成后被降解成多肽,并与 MHC(主要组织相容性复合体)分子结合形成复合物,被呈递到细胞表面。
TCR-T 疗法通过 TCR 识别 HLA-抗原复合物,从而精准的消灭肿瘤细胞,具有 HLA 的限制性。本文所介绍的 Tecelra® 即是特异性识别 MAGE-A4 特异性抗原肽的 TCR-T。
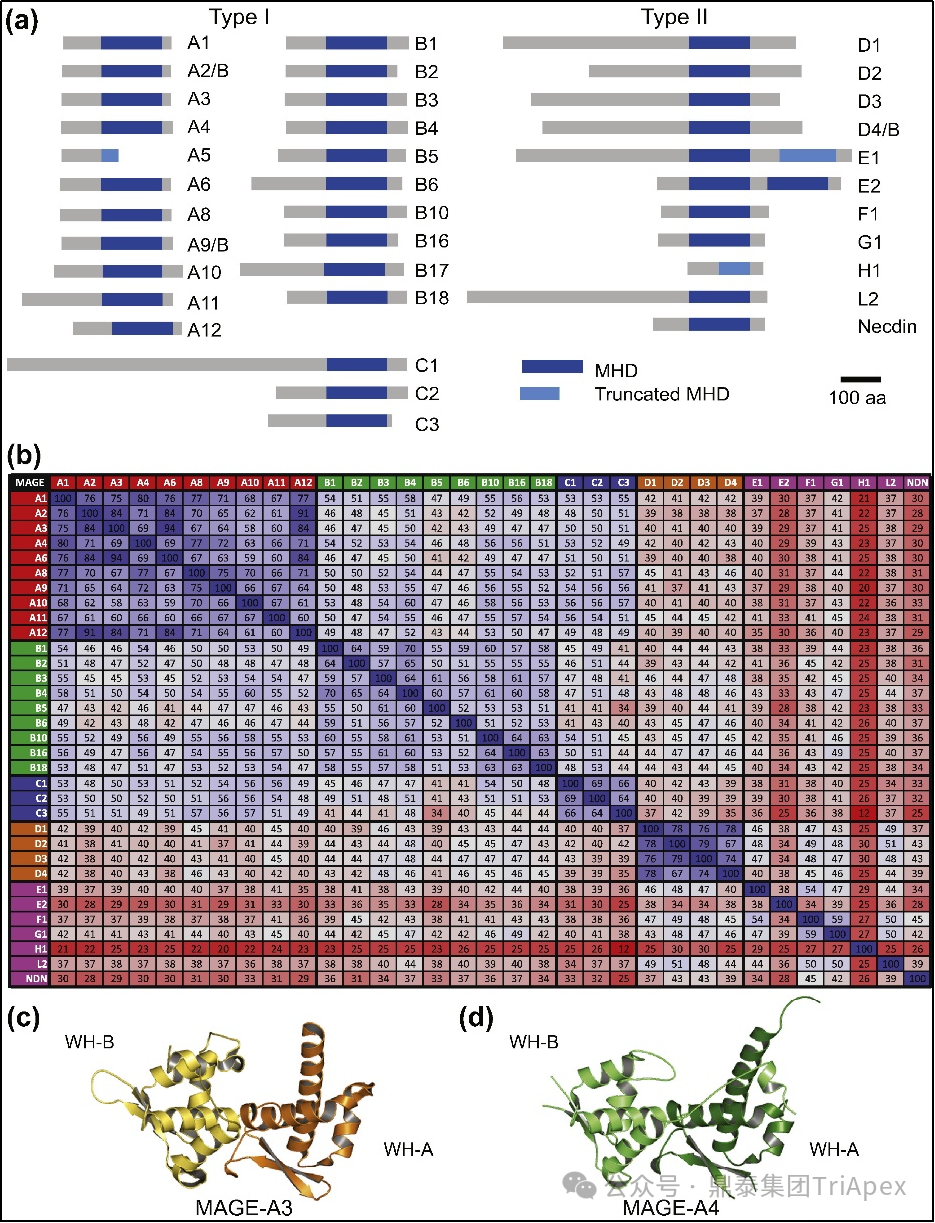
图1. MAGE 同源结构域(Homology domain)[1]
(a)人类 MAGE 蛋白及其保守的 MAGE 同源结构域(MHD)列表,以蓝色突出显示;(b)各种人类 MHD 之间相同氨基酸的百分比;(c)MAGE-A3 和 (d) MAGE-A4 MHD 的晶体结构
2
人类白细胞抗原
在人类中 MHC 被称为 HLA。HLA 基因复合体位于第 6 号染色体的短臂 (6p21.3) 上。
| HLA 的分类
HLA Ⅰ 类、Ⅱ 类、Ⅲ类基因区[3]:
Ⅰ 类:包括 HLA-A、HLA-B、HLA-C 等,主要功能是将内源性肽呈递给应答的 CD8+ T 细胞,HLA Ⅰ 类分子是由重链(α 链)和轻链(β2m)组成的异二聚体, 重链约为 45 kDa。编码 β2m 的基因位于 15 号染色体上,不包含在 HLA 复合体中。
Ⅱ 类:包括 HLA-DR、HLA-DQ 和 HLA-DP 等。处理外源性肽呈递给 CD4+ 辅助性 T 细胞。
Ⅲ 类:包含具有免疫功能的蛋白质基因。其包含编码免疫调节分子的基因,例如肿瘤坏死因子(TNF)、补体因子 C3、C4 和 C5 以及热休克蛋白。
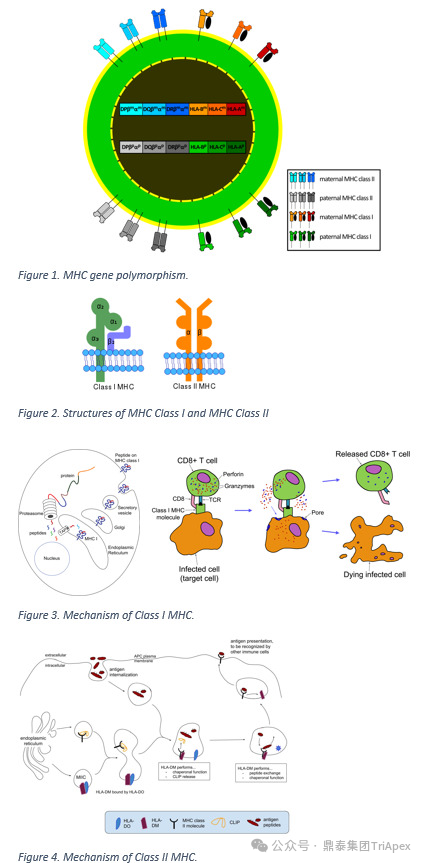
图2. HLA 基因多态性、结构和机制[2]
| HLA 等位基因的命名法
每个 HLA 等位基因名称都有一个唯一的编号,最多对应于四组数字,用冒号分隔。
CD8+T 细胞的杀伤能力依赖于 TCR 对 HLA Ⅰ 类分子呈递的肿瘤抗原的特异性识别;CD4+T 细胞的调节功能依赖于 TCR 对 HLA Ⅱ 类分子呈递的抗原识别。因此,选择接受 TCR-T 疗法的患者,不仅必须表达靶向抗原,还必须表达相应的抗原限制性 HLA 等位基因。
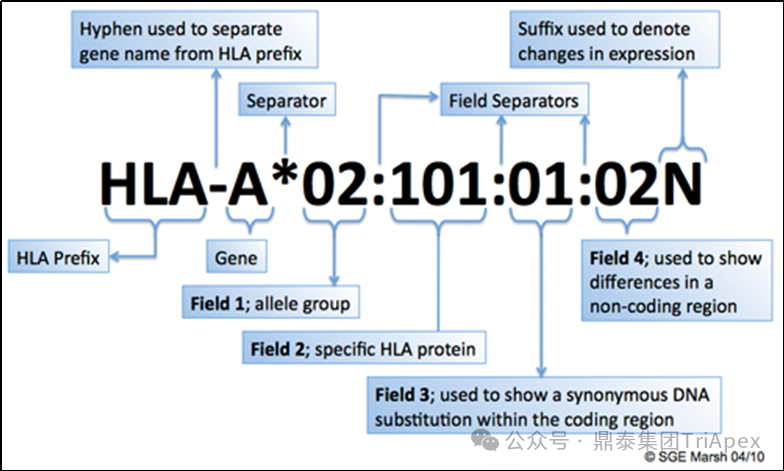
图3. HLA-A 等位基因的命名规则[4]
Field 1:等位基因亚型;Field 2:特定的HLA蛋白;Field 3:编码区同义突变;Field 4:非编码区突变
3
滑膜肉瘤及现有治疗方法
滑膜肉瘤(Synovial sarcoma,SS)是一种罕见的软组织肉瘤(Soft tissue sarcoma,STS),约占所有组织学类型的 5% 至 10%。SS 的致癌驱动因素是 X 染色体和 18 号染色体之间的易位,导致 SS18:SSX 融合癌基因的生成。
晚期不可切除或转移性 SS 的标准一线治疗包括联合蒽环类药物的化疗方案。对于最佳二线治疗方案尚无共识。培唑帕尼(Pazopanib)是唯一获得 FDA 批准用于治疗接受过系统治疗的晚期 STS 患者的药物。其批准基于培唑帕尼的中位无进展生存期(PFS)为 4.6 个月,而安慰剂组为 1.6 个月。在 SS 患者亚组(n=25)中,培唑帕尼组中位 PFS 为 41 个月,安慰剂组为 0.9 个月。总的来说,培唑帕尼的总缓解率(ORR)为 4%(95% 可信区间为 2.3-7.9),中位缓解持续时间(DOR)为 9 个月(95% 可信区间为 39-9.2)。培唑帕尼在 SS 亚组中未报告 ORR。培唑帕尼与总生存期(OS)无关[5]。
产品信息
1
产品信息和产品特征
Tecelra® 由自体 T 细胞组成,采用 MAGE-A4-c1032 慢病毒载体(LVV)进行基因修饰,表达人类 MAGE-A4 特异性亲和力增强型 T 细胞受体(TCR)。该 TCR 可识别 HLA-A*02- 限制性 MAGE-A4 肽 GVYDGREHTV。MAGE-A4 TCR 编码序列由 TCRα 链和 TCRβ 链组成。在用 MAGE-A4-c1032 LVV 转导的T细胞中,MAGE-A4 TCRα 和 β 链与内源性的 CD3 链形成功能性 TCR 复合物[4]。
构建体结构示意图和产品特征分别见图 1 和表 1,相关专利基本信息见图 5 和图 6。
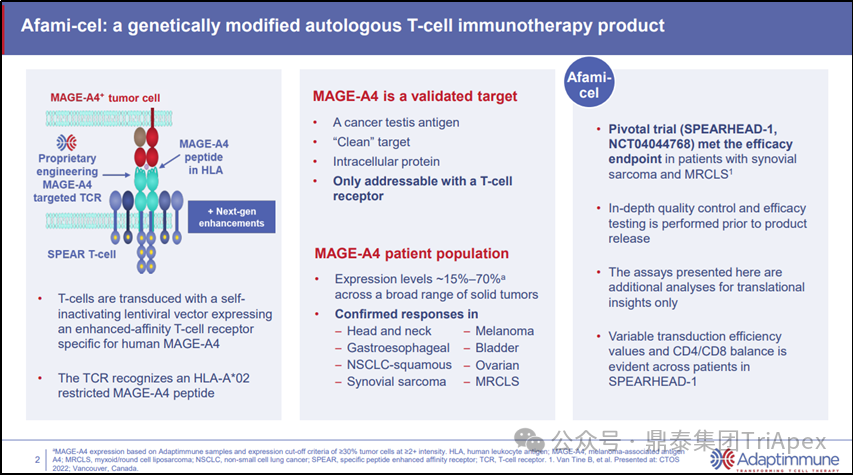
图4. Tecelra® 构建体结构示意图[6]
表1. Tecelra® 的产品特征[7]

*回输后,血清 IFN-γ、IL-6、L-8、IL-15 和 L-2Rα 的峰值在3-8 天
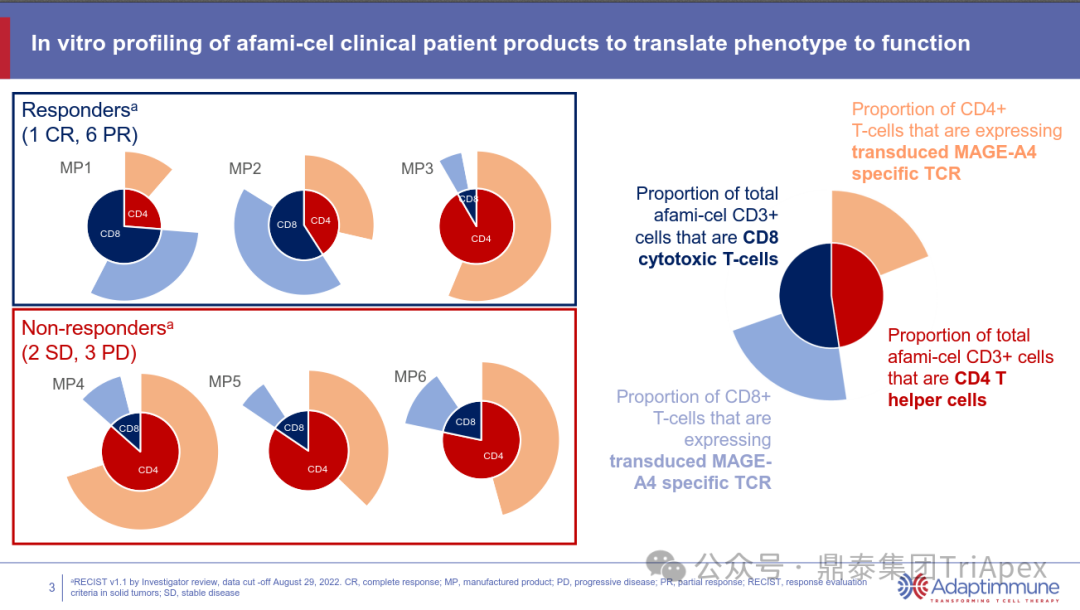


图5. T 细胞修饰专利(CN 113677352 A、WO_2020109616_A1)
MAGE-A4 TCR 添加 CD8α 同源二聚体,增加 TCR 结合亲和力



图6. T 细胞受体专利(CN 109476725 B、WO_2017174824_A1)
2
适应症
针对 MAGE-A4 的遗传修饰自体T细胞免疫疗法,适用于先前接受过化疗、HLA-A*02:01P, -A*02:02P, -A*02:03P, 或 -A*02:06P 阳性且肿瘤表达 MAGE-A4 抗原的不可切除或转移性滑膜肉瘤成人的治疗[8]。

图7. 适应症[8]
3
用法用量
推荐剂量为 2.68×109 至 10×109 MAGE-A4 TCR 阳性 T 细胞,单次静脉输注。Tecelra® 以单一剂量提供,装在一个或多个输液袋中用于输注。

图8.用药剂量和给药方法[8]
4
黑框警告及不良反应
根据 FDA 说明书,Tecelra® 的黑框警告为严重或致命的细胞因子释放综合征(CRS),该综合征可能很严重或危及生命。

图9. 黑框警告[8]
最常见的不良反应(≥ 20%)包括 CRS、恶心、呕吐、疲劳、感染、发热、便秘、呼吸困难、腹痛、非心源性胸痛、食欲下降、心动过速、背痛、低血压、腹泻和水肿。最常见的 3 级或 4 级实验室异常 (≥ 20%) 包括淋巴细胞计数减少、中性粒细胞计数减少、白细胞计数减少、红细胞减少和血小板计数减少[7]。
5
伴随诊断
Adaptimmune 与 Agilent 合作开发、制造和供应 MAGE-A4 生物标志物的体外伴随诊断,并与 Thermo Fisher 合作扩展高分辨 HLA 分型产品 SeCore™CDx HLA-A 说明书,以用于 Tecelra® 患者 HLA 的筛选。

图10. SeCore™CDx HLA-A
2024 年 8 月,MAGE-A4 IHC 1F9 pharmDx 在美国获得批准,作为一种伴随诊断工具,用于筛选符合条件的滑膜肉瘤患者。MAGE-A4 IHC 1F9 pharmDx (SK032)是 Agilent 公司开发的一种免疫组织化学(ICH)检测方法,用于检测福尔马林固定、石蜡包埋的滑膜肉瘤组织中 MAGE-A4 表达[7]。
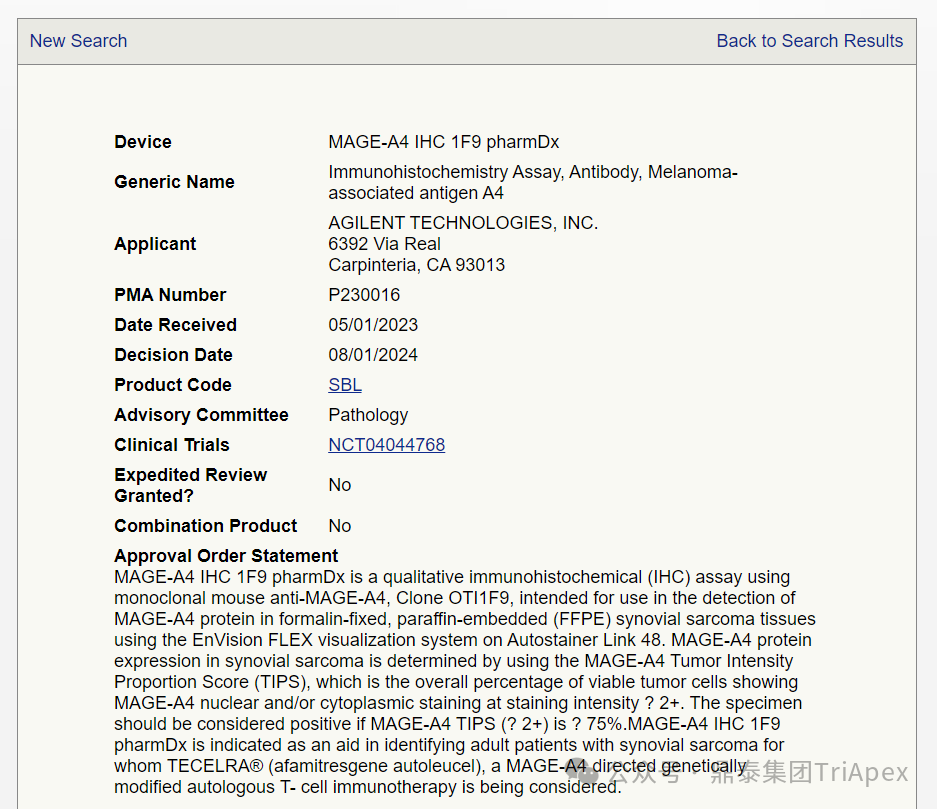
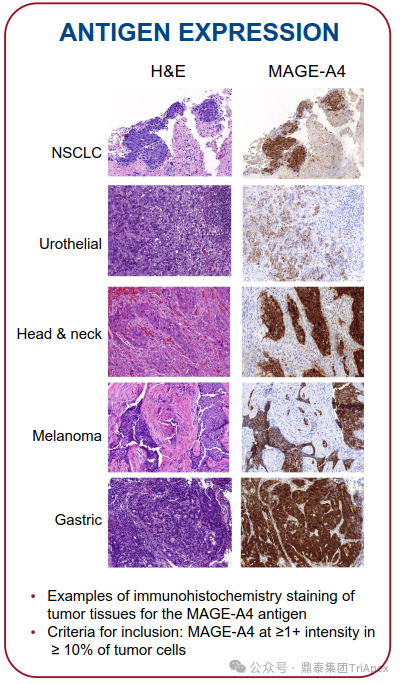
图11. MAGE-A4 IHC 1F9 pharmDx
Tecelra® 非临床研究
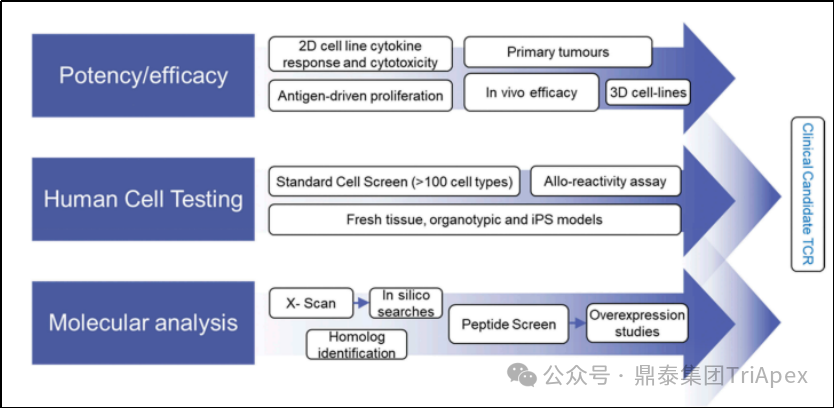
图12. 亲和力增强型 TCR 的临床前筛选过程
1
药效学(含体外、体内药效学及特异性评估)
(1)对 MAGE-A4 阳性肿瘤细胞的体外杀伤活性
通过 ELISA 和 ELISpot 分别检测了 Tecelra® 与 MAGE-A4 阳性的肿瘤细胞系和 MAGE-A4 阳性的原发性黑色素瘤组织(Primary tumor material)孵育后 IFN-γ 的释放情况。结果显示,Tecelra® 对 MAGE-A4 阳性的细胞系和 MAGE-A4 阳性的原发性黑色素瘤产生了强烈的 IFN-γ 反应。此外,在贴壁细胞和 3D 显微组织中,Tecelra® 有效杀伤表达 HLA-A*02 和 MAGE-A4 的肿瘤细胞系。
综上,Tecelra® 在多种实验条件下对 MAGE-A4 阳性的肿瘤细胞具有显著的免疫反应和细胞毒性作用。
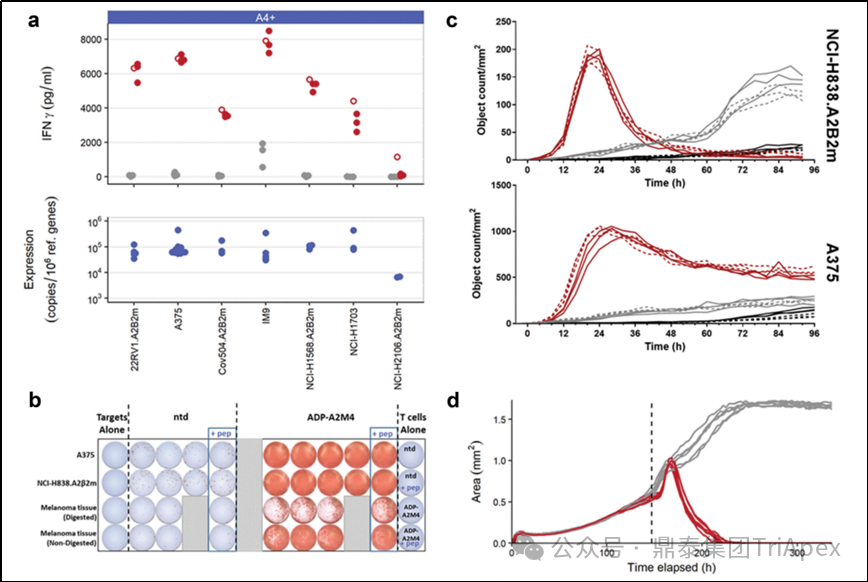
图13. Tecelra® 对 MAGE-A4+ 和 HLA-A*02:01 肿瘤细胞的体外抑制作用
(a)Tecelra® 作用于 MAGE-A4+ 肿瘤细胞释放 IFN-γ(ELISA);通过 qPCR 检测肿瘤细胞 MAGE-A4 的表达。(b)Tecelra® 作用于原发性黑色素瘤组织释放 IFN-γ(ELISpot)。(c)Tecelra® 对两种表达 MAGE-A4 的肿瘤细胞产生细胞毒性(IncuCyte显微镜测定)。(d)Tecelra® 对 3D 微组织中培养的 GFP+MAGE-A4+ 肿瘤细胞 A375 具有细胞毒活性(IncuCyte显微镜测定)。
(2)体内抗肿瘤作用
采用裸小鼠皮下或静脉注射人黑色素瘤细胞系建立异种移植肿瘤模型。Tecelra® 单次静脉注射给药,对单个、大的皮下注射肿瘤和小的弥漫性肿瘤均可见剂量依赖性抗肿瘤作用。在这两项研究中,在最高剂量(3 × 106)下,观察到明显的肿瘤消退和 100% 的动物存活率。
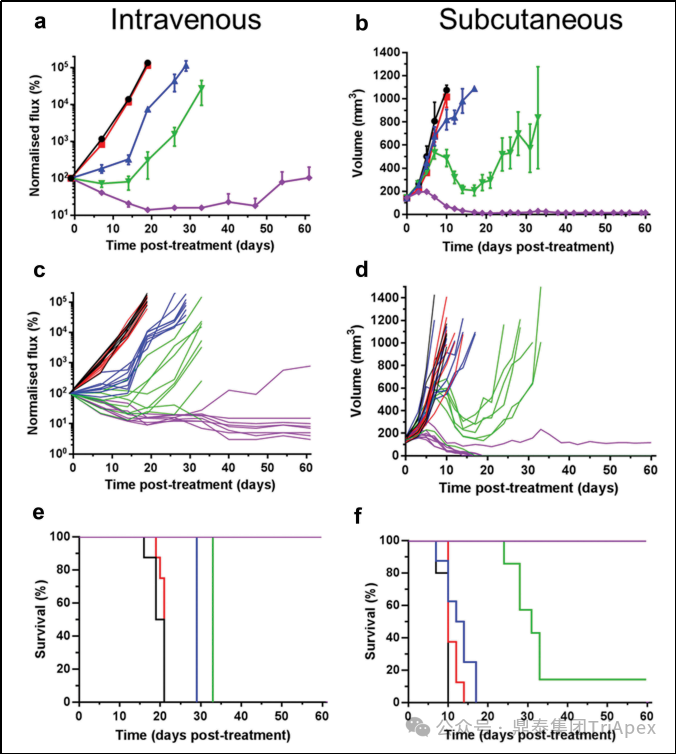
图14. Tecelra® 剂量依赖性抑制 MAGE-A4+A375 肿瘤的生长
黑线:无处理;红线:3 × 106个未转导的T细胞;蓝色、绿色和紫色线条:3 × 105、1 × 106 和3 × 106 Tecelra®;静脉注射组(a,c,e)或皮下注射组(b,d,f)
(3)对抗原阴性细胞的交叉反应
Tecelra® 与 HLA-A*02:01+ MAGE-A4− 原代正常细胞和多种细胞类型的肿瘤衍生细胞系孵育后,采用 IFN-γ ELISA 法检测 IFN-γ(后文简称IFN-γ ELISA法)以评估 T 细胞活化情况,评估Tecelra® 的脱靶交叉反应性。结果显示,几乎所有测试的 MAGE-A4− 细胞类型均未诱导 T 细胞活化。
(4)同种异体反应(Alloreactivity)性评估
通过一组表达多种 HLA 等位基因的 EBV 转染的 B 淋巴母细胞系(B-LCLs)对同种异体反应性进行考察。结果显示,Tecelra® 对表达 HLA-A*02:05 的两种细胞系产生了应答(IFN-γ-ELISA法)。另外,三种表达 HLA-A*02:05 的原代细胞系中,两种细胞系表现出对 Tecelra® 的反应。
为了探索这种潜在的同种异体反应性,通过慢病毒将一组常见的 HLA-A2 等位基因转染到 MAGE-A4-HLA-A2 原代 Schwann 细胞系 HSC6 中,并通过 IFN-γ ELISA 法评估它们诱导 Tecelra® 反应的能力。HLA-A*02:05 的引入,导致了强烈的 Tecelra® 反应,证明了 Tecelra® 的同种异体反应性。
因此,表达 HLA-A*02:05 的患者不可接受 Tecelra® 治疗,这与后来批准的适应症人群相吻合。
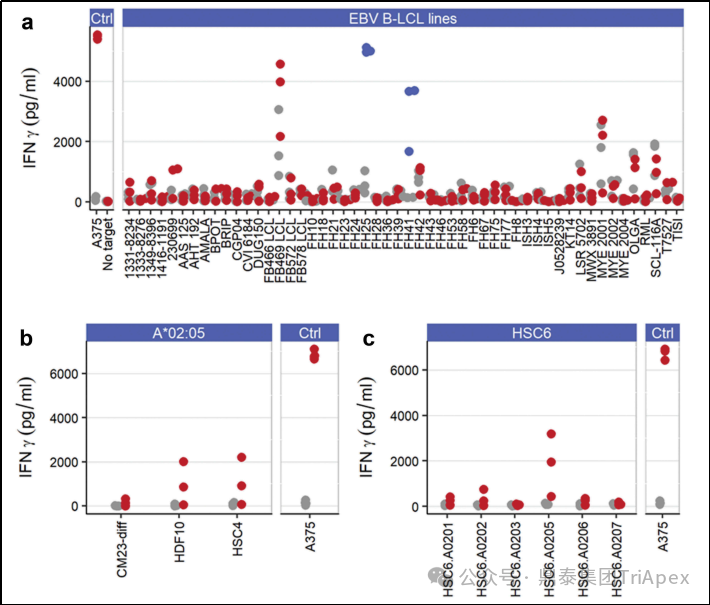
图15. Tecelra® 对 HLA-A*02:05 表现出同种异体反应性
(a)Tecelra® 对两种 HLA-A*02:05 EBV 衍生的 B-LCL(FH25、FH41;蓝点)有反应,但对其他细胞系没有反应。(b)Tecelra® 诱导 HLA-A*02:05 的人原代细胞(2/3)反应。(c)Tecelra® 对转导表达 HLA-A*02:05 的人原代 Schwann 细胞有反应,但对其他 HLA-A2 等位基因没有反应。Tecelra®(红点或蓝点)和未转导细胞(灰点)。
为了确定 Tecelra® 是否识别 MAGE 家族中的其他肽段,通过蛋白质序列比对(n = 30)分析来自于指示肽(index peptide)同源的 MAGE 蛋白家族所有成员的肽段,然后通过 IFN-γ ELISA 法筛选其激活 Tecelra® 的能力。研究者使用了 NALM6 细胞(HLA-A*02:01+MAGE−),并使其过表达 MAGE-A4、MAGE-A8、MAGE-B2、MAGE-B4 或 MAGE-B6 以评估 Tecelra® 对这些蛋白的反应性。
从上述蛋白中鉴定出两种肽 MAGE-A8 和 MAGE-B2 可引起中度反应。虽然 MAGE-A8 在大脑(GTEx portal)中有低水平表达,但反应性比 MAGE-A4 弱得多,而 MAGE-B2 仅限于睾丸和胎盘表达,因此上述交叉反应预期在临床研究中引起脱靶反应(off-target reactions)的担忧较小。
2
安全性
Tecelra® 是一种自体 TCR-T 细胞疗法,由于其 TCR 与动物 TCR 所识别的 MHC 抗原肽不同,因此难以评估其特异性。同时,人源化小鼠模型中输注人 T 细胞后,通常会在 8 周内出现致死性异种移植物抗宿主病(GvHD),这限制了该模型的使用。
由于缺乏合适动物模型以及考虑到产品的特点,Tecelra® 未开展单次给药毒性试验、重复给药毒性试验、遗传毒性试验、致癌性试验、生殖毒性试验和免疫原性研究。由于 MAGE-A4 TCR 源自人类 TCR,预计不会产生免疫原性。

图16.安全性评价(FDA NDA/BLA Multi-disciplinary Review and Evaluation)
通常标准的遗传毒性组合试验不适用于细胞和基因治疗类产品的遗传毒性评价。FDA 和申请人均关注到,载体整合可能具有插入性突变风险,原癌基因的激活或抑癌基因的破坏可能会引起继发性恶性肿瘤。载体整合位点分析表明,该产品所采用的 LVV 的插入位点特征与其他慢病毒载体产品相似,预计发生恶性肿瘤的风险较小。
Tecelra® 临床开发路径
1
上市历程
Tecelra® 从获孤儿药认定(ODD)到获批上市历时约 5 年,共开展了 2 项临床试验(NCT03132922、NCT04044768)支持上市。最终获批上市的适应症为:先前接受过化疗、HLA-A*02:01P 或 -A*02:02P 或 16 -A*02:03P 或 -A*02:06P 阳性且肿瘤表达 MAGE-A4 抗原的不可切除或转移性滑膜肉瘤成人患者。
主要监管里程碑如下:
2016 年,提交 IND 申请
2017 年,靶向 MAGE-A4 多种实体瘤 IND 获 FDA 批准
2019 年,获 FDA ODD 认定,用于软组织肉瘤的治疗
2024 年 1 月,提交 BLA
2024 年,获优先审评资格
2024 年 8 月,获 FDA 加速批准上市
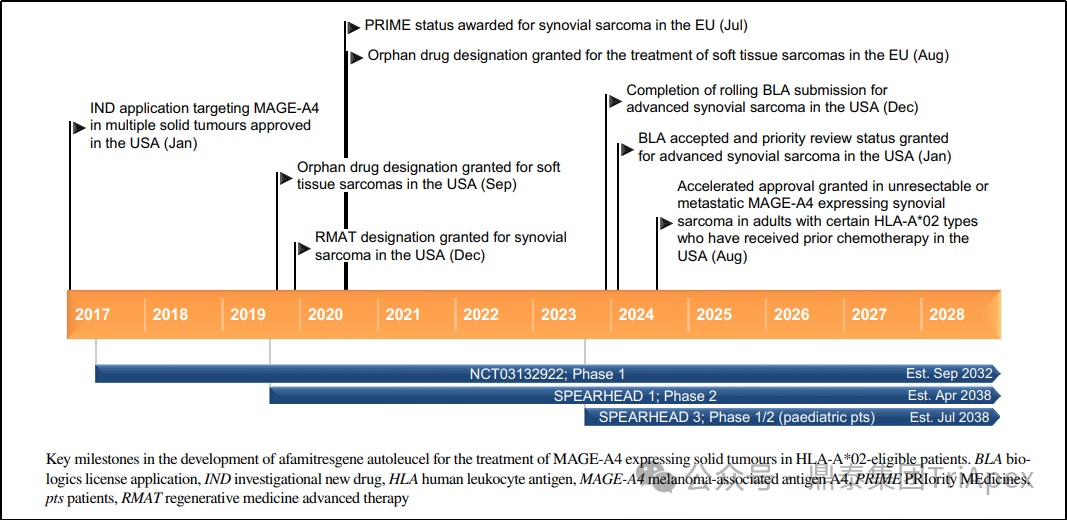
图17. 上市历程[7]
表2.临床试验
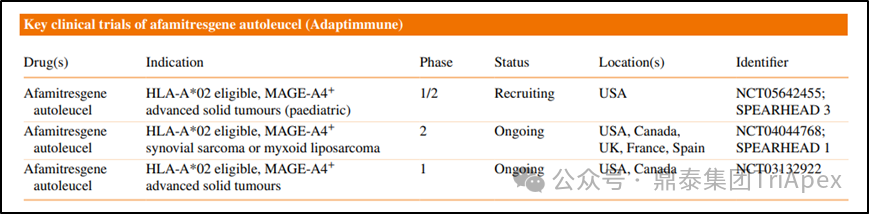
表3. 监管历史[7]
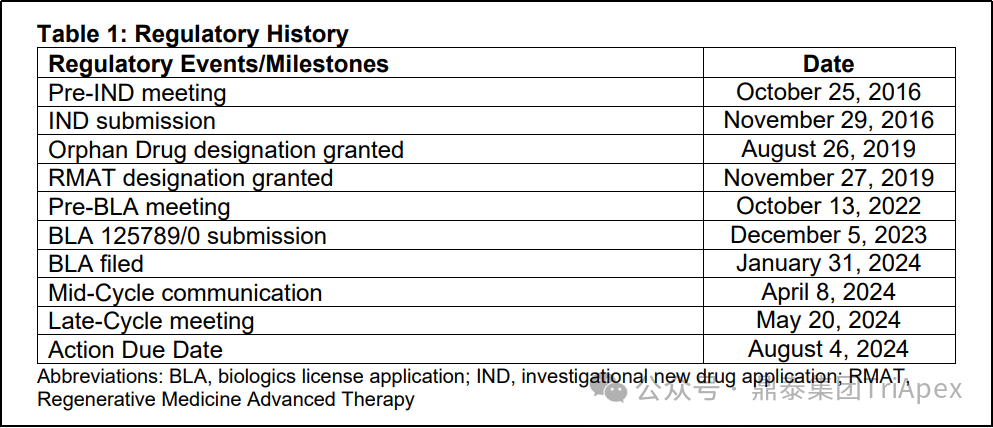
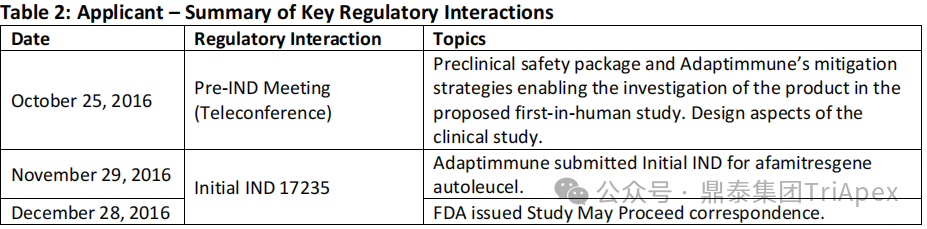
表4. 监管互动[10]


2
Ⅰ期临床试验[11]
评估 Tecelra® 在 HLA-A2+MAGE-A4+ 肿瘤受试者中的安全性、耐受性和抗肿瘤活性的I期剂量递增、多肿瘤研究(NCT03132922)。
主要终点:评价 Tecelra® T细胞治疗的安全性和耐受性。
次要终点:评价 Tecelra®T 细胞的抗肿瘤活性;评估在输液后长期随访 15 年内潜在的与治疗相关的延迟性 AE。

图18. Ⅰ期临床试验(NCT03132922)临床试验终点
1) 患者筛选
HLA 检测至少包含一个 HLA- A2 等位基因(HLA- a *02:01、HLA- a *02:02、HLA- a *02:03、HLA- a *02:06 或 HLA- a*02:09),且没有等位基因 HLA- a *02:05
使用抗 MAGE-A4 IHC 法对肿瘤活检标本进行 MAGE-A4 表达水平检测
仅 HLA-A2 且 MAGE-A4 高于预设 Cutoff 水平的患者才可入组
2) 试验设计
采用 3+3 试验设计,包括 Tecelra® 组别1、组别 2、组别 3 和扩展组(共4组):
组别1 :0.08×109 to 0.12×109 cells(n=3, 均为卵巢癌患者)
组别 2 :0.5×109 to 1.2×109 cells(n=3,均为卵巢癌患者)
组别 3:1.2×109 to 6.0×109 cells(n=3,1名食管胃交界癌, 1 名卵巢癌和 1 名滑膜肉瘤)
扩展组:1.2×109至10×109 cells (n=29;1名贲门癌, 1 个食管癌,3 名头颈癌, 1 名黑色素瘤, 5 个黏液样圆细胞脂肪肉瘤 (MRCLS), 2 名卵巢癌, 15 名滑膜肉瘤和 2 名尿路上皮癌)
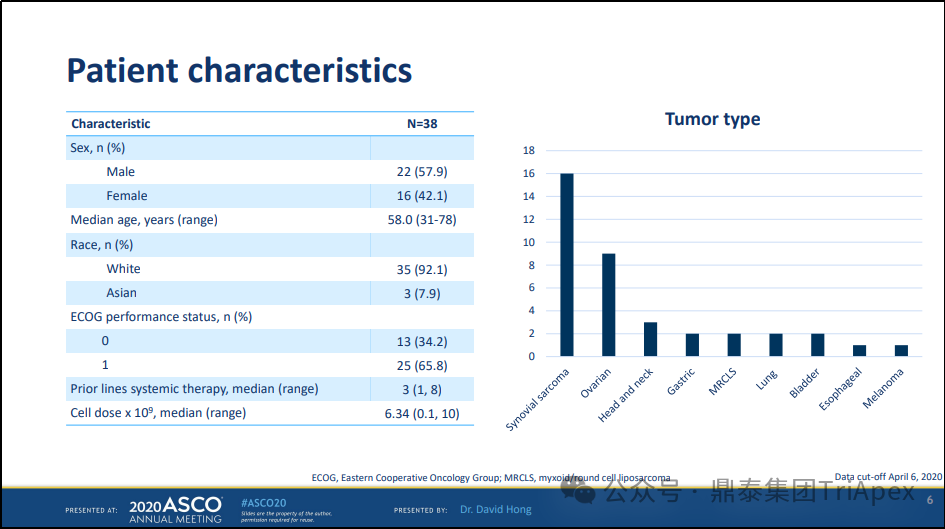
图19.患者特征
| 清淋预处理
Group 1 和 Group 2 在 - 7、- 6 和 - 5 天接受环磷酰胺(600 mg/m2 /天),在 - 7、- 6 和 - 5 天接受氟达拉滨(30 mg/m2 /天)清淋方案。
Group 3 和 Expansion group(n=22)在 - 7、- 6 和 - 5 天接受环磷酰胺(600 mg/m2 /天),在 - 7、- 6、- 5 和 -4 天接受氟达拉滨(30 mg/m2 /天)清淋方案。
扩展组中有 7 名患者在 -3 天和 -2 天接受了更高剂量的环磷酰胺(1,800 mg/m2/天)以及在 -5 天 -4 天、-3 天和 -2 天氟达拉滨(30 mg/m2/天)清淋方案。
每次剂量增加前均评估剂量限制性毒性(DLT),剂量逐渐增加到扩展组中的 1.2×109 到 10.0×109 细胞。
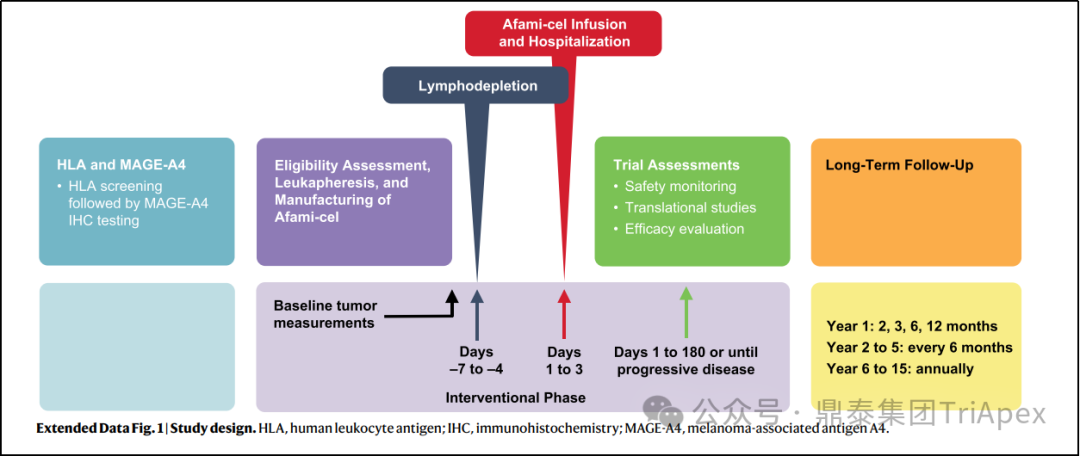
图20. NCT03132922试验设计
3) 安全性
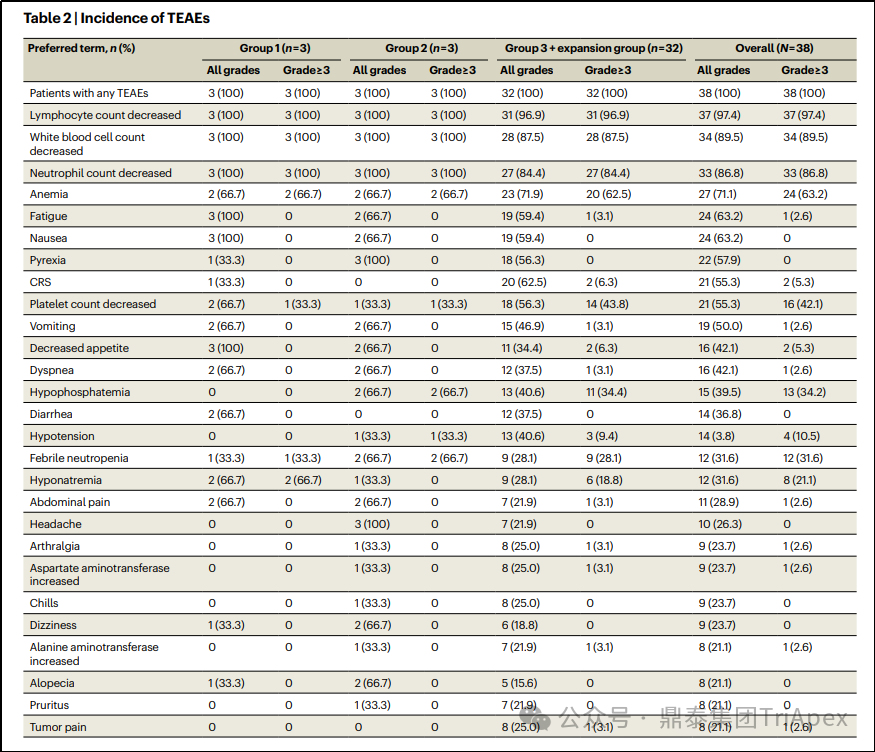
由安全审查委员会确定的 DLTs 发生在 6 名患者中,包括细胞减少(cytopenias,4 例)、再生障碍性贫血(1 例)和脑血管疾病(1 例);所有的 DLTs 均发生在剂量扩展组(中位剂量,7.85 × 109 个转导细胞)。
38 例患者在治疗期间出现的不良事件(TEAEs)均 ≥3 级;血液学毒性是最常见的,包括淋巴细胞细胞计数减少(97%)、中性粒细胞减少(87%)和血小板减少(42%)和贫血(63%)。≥3 级发热性中性粒细胞减少症和全血细胞减少症发生率分别为 32% 和 11%。17 例患者(45%)可见持续性血细胞减少症(Prolonged cytopenia),定义为 >3 级中性粒细胞减少症、贫血或血小板减少症在 Tecelra® 治疗后第 4 周持续存在,其中 9 名(24%)中性粒细胞减少症延长。与治疗相关的严重全身性感染少见(3%)。
表5. TEAEs 的发生率
患者在清淋和 Tecelra® 细胞输注后数周内可能出现细胞减少,再生障碍性贫血有一个相关的致命 SAE。

图21. 安全性:持续性的细胞减少
4) 有效性
检测输注后外周血中抗原肽特异性高亲和力受体(Specific Peptide Enhanced Affinity Receptor,SPEAR) T 细胞(后文简称 SPEAR-T)和载体拷贝数(qPCR,针对载体基因组中的包装信号序列)的变化,进行性疾病患者的载体拷贝数较少、SPEAR T 细胞较少。
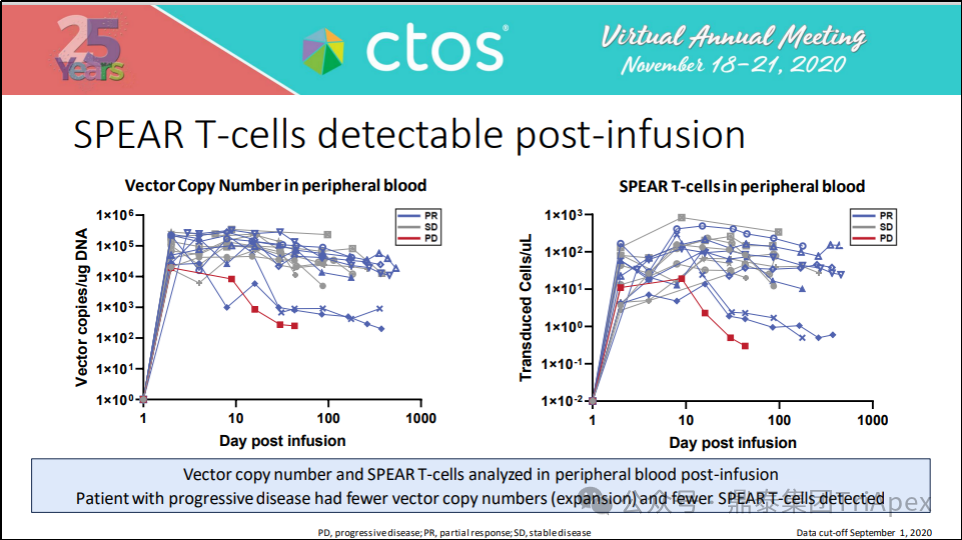
图22.有效性
部分缓解(Partial response, PR)、病变稳定(Stable disease, SD)、病变进展(Progressive disease, PD)
5) 其他
通过对 92 种免疫肿瘤相关血清蛋白分析,Tecelra® 给药后变化最大的标志物包括 IFN-γ 及其相关标志物。
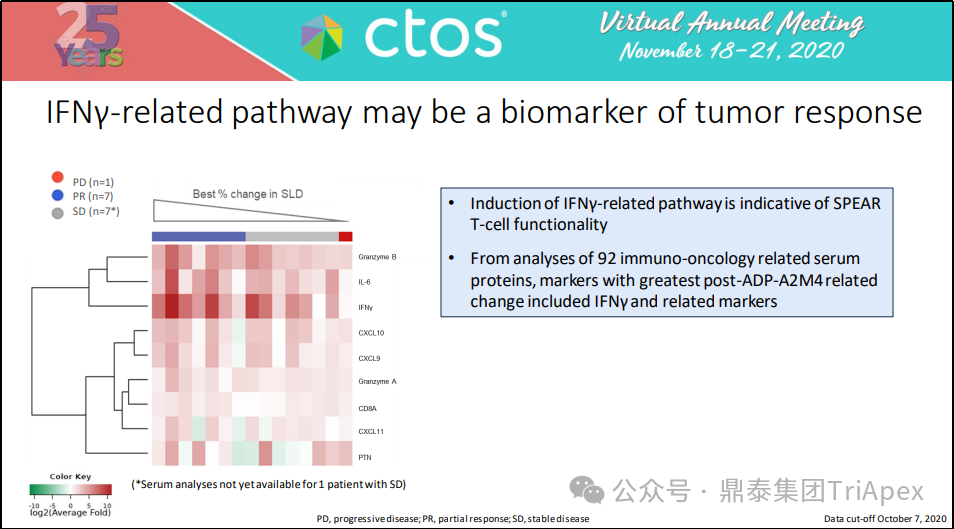
图23. IFN-γ 相关途径(IFN-γ-related pathway)可能是肿瘤反应的生物标志物
MAGE-A4 表达及转导细胞剂量与肿瘤变小相关:MAGE-A4 表达相对较高的患者、转导细胞剂量相对较大的患者可能有更大程度的靶病灶直径的减少。
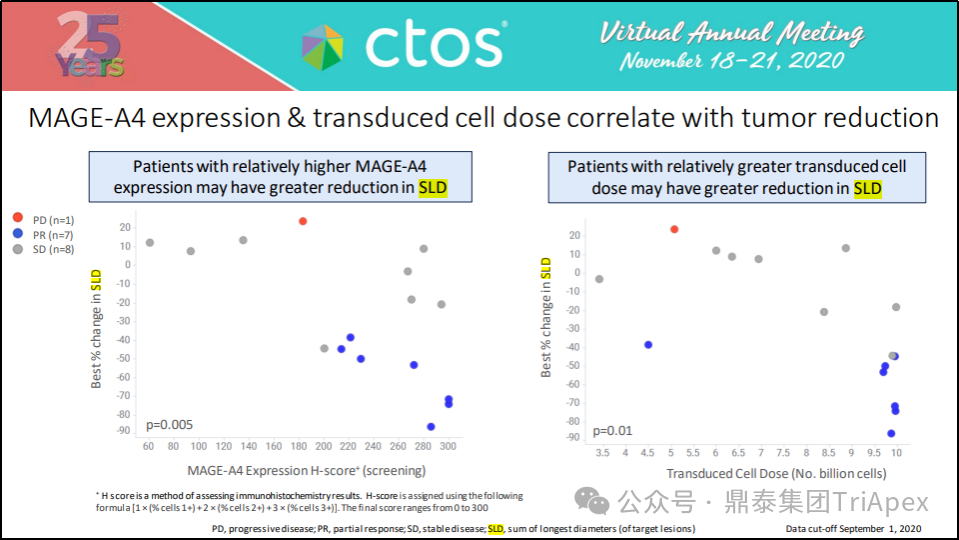
图24. MAGE-A4 表达及转导细胞剂量与肿瘤减轻相关
小结
安全性
大多数不良事件与癌症患者在接受淋巴清除细胞毒化疗和细胞治疗时出现的不良事件一致。
有效性
在晚期滑膜肉瘤人群中观察到高 ORR和持续的 DOR。
其他
Tecelra® SPEAR-T 细胞在输液后扩增、存活
IFN-γ 相关途径可能是肿瘤反应的生物标志物
靶病灶的减小程度与 MAGE-A4 的表达和转导细胞剂量相关
3. 关键临床试验 SPEARHEAD-1(Phase 2,NCT04044768)[12]
2024 年 8 月 2 日,FDA 加速批准了 Tecelra®,该上市申请基于如下关键性临床试验:
评估 Tecelra® 在患有转移性或不能手术(晚期)滑膜肉瘤(队列 1、2 和 3)或粘液样/圆细胞脂肪肉瘤(MRCLS)(队列1)中符合 HLA-A*02 条件和 MAGE-A4 阳性受试者中的疗效和安全性。支持上市的为队列 1 的试验结果。
主要疗效:
ORR 为 43.2%(95% 置信区间 [CI]:28.4,59.0)。中位至起效时间(mTTR)为 4.9 周(95% CI:4.4 周,8周)。
mDOR 为 6 个月(95% CI:4.6,未达到)。在对治疗有反应的患者中,45.6% 和 39.0% 患者缓解持续时间分别大于或等于 6 个月和 12 个月。
TCR-T 细胞疗法以 HLA 限制性方式靶向肿瘤抗原。对于评估针对 MAGE-A4 的 TCR T 细胞疗法的临床试验,NCT04044768 研究中根据以下因素评估患者入排资格:
(1)高分辨率 HLA 分型:基于 Sanger 测序的 HLA 分型方法-SeCore assay(One Lambda, Thermo Fisher Scientific, Los Angeles, CA),已获得 FDA 的 510(k)批准。
(2)IHC:在 HLA 符合条件的患者中,通过 IHC 的方法检测肿瘤 MAGE-A4 的表达。
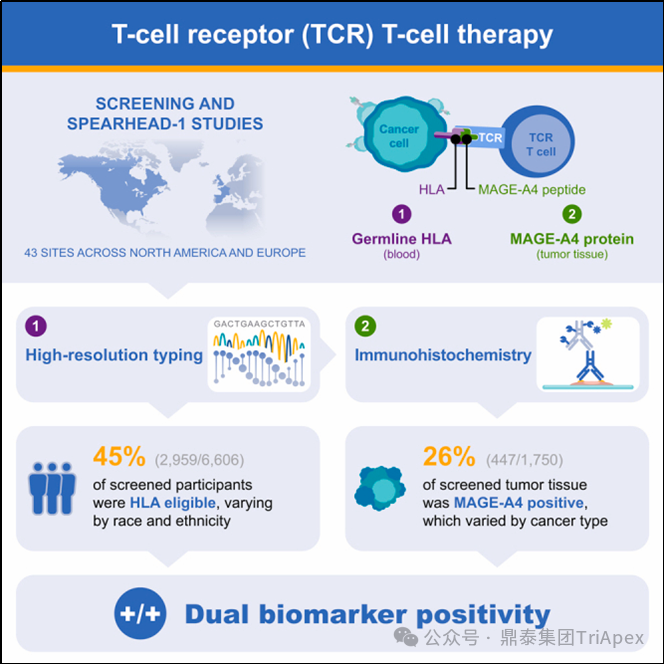
图25. SPEARHEAD-1(Phase 2,NCT04044768)入排资格[13]
| 试验设计
队列 1 包括患有转移性或不可切除的滑膜肉瘤(44名)或粘液样/圆细胞脂肪肉瘤(8名)HLA-A*02 并表达 MAGE-A4,并且之前至少接受过一线含蒽环类药物或含异环磷酰胺化疗的患者,年龄为 16-75 岁。在清淋后,患者接受单次静脉注射 Tecelra®(剂量范围为1.0x109-10.0x1010细胞)。主要终点为 ORR,次要终点为 AE、SAE、TTR、DOR、PFS 等。
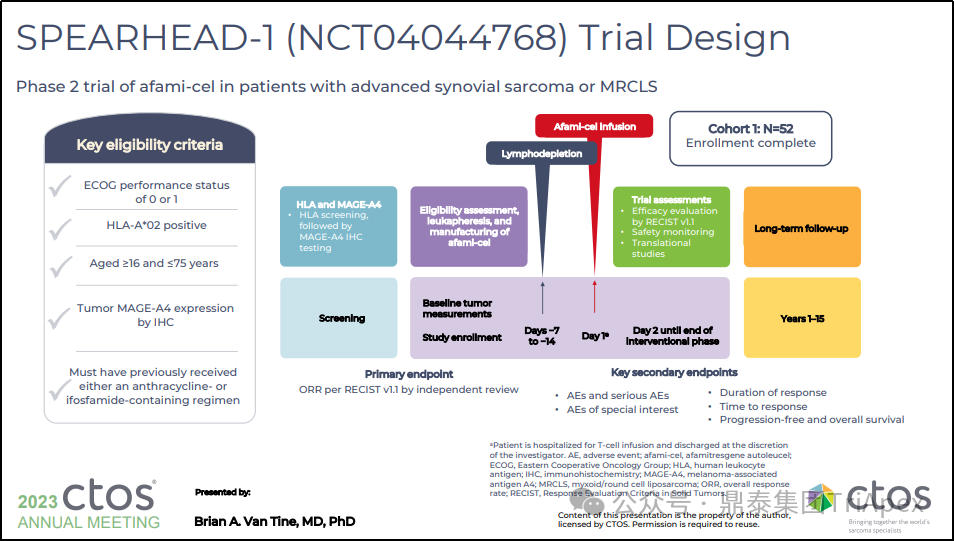
图26. SPEARHEAD-1(Phase 2,NCT04044768)试验设计
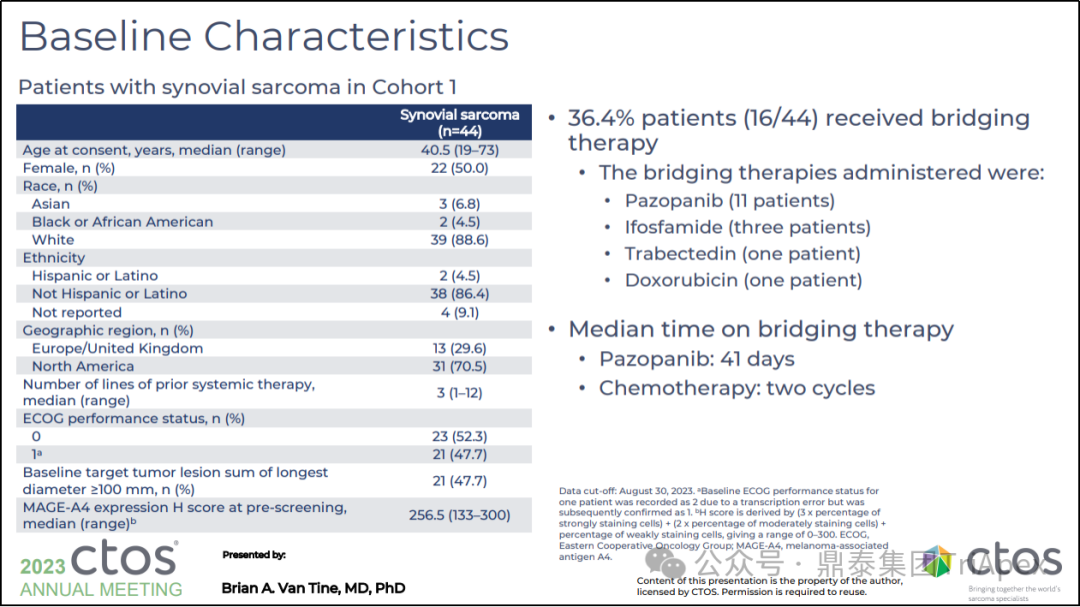
图27. SPEARHEAD-1(Phase 2,NCT04044768)队列1患者信息
| 安全性
所有接受治疗的 52 名患者中最常见的 3 级或更严重的 TEAEs:50 例(96%)患者发生淋巴细胞减少,44 例(85%)患者发生中性粒细胞减少,42 例(81%)患者发生白细胞减少。10 名(19%)患者出现持续性细胞减少(在T细胞输注后第 4 周出现 3 级或更严重的细胞减少),包括 5 名(10%)患者出现中性粒细胞减少,4 名(8%)患者出现贫血,3 名(6%)患者出现血小板减少。52 例患者中 48 例(92%)发生与 T 细胞输注有关的不良事件,其中常见不良事件为血液毒性。
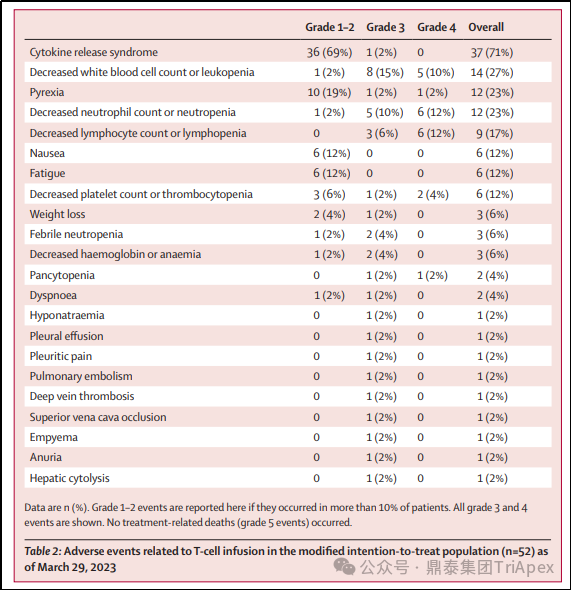
图28. SPEARHEAD-1(Phase 2,NCT04044768)不良反应
CRS 大多为 1-2 级,但 52 例患者中有 1 例(2%)为 3 级事件。5 例(10%)患者发生严重事件。在 Tecelra® 输注后早期发生,发病时间中位数为 2 天(OR2-3),缓解时间中位数为 3 天(2-5)。CRS 通过支持性治疗进行干预,19 例患者(37%)接受托珠单抗;19 例患者中有 2 例需要皮质类固醇,所有病例均缓解。1 例(2%)患者出现免疫效应细胞相关性神经毒性综合征(1级)及伴随的 CRS,神经毒性症状 1 天后消失。
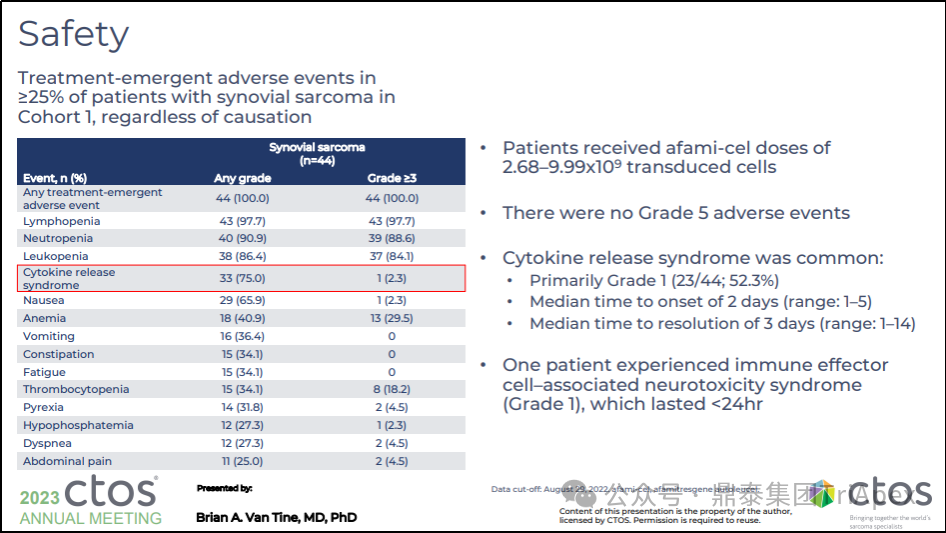
图29. SPEARHEAD-1(Phase 2,NCT04044768)不良反应
| PFS
中位 PFS 为 3.8 个月(95% Cl:2.8-6.4)
在有响应的(RECIST)17 例滑膜肉瘤患者中,PFS 的中位数为 14.3 个月,24 个月 PFS 概率为 20%
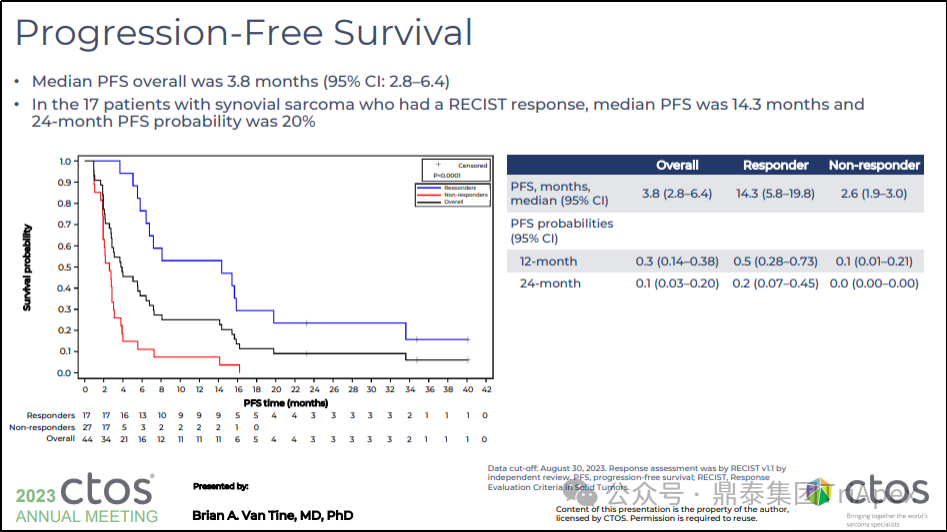
图30. SPEARHEAD-1(Phase 2,NCT04044768)PFS
| 下一步治疗和死亡
出现进展的 20 例患者采取其他全身治疗
Tecelra® 单次注射后,24 个月内存活和未有其他治疗的生存率为 30%
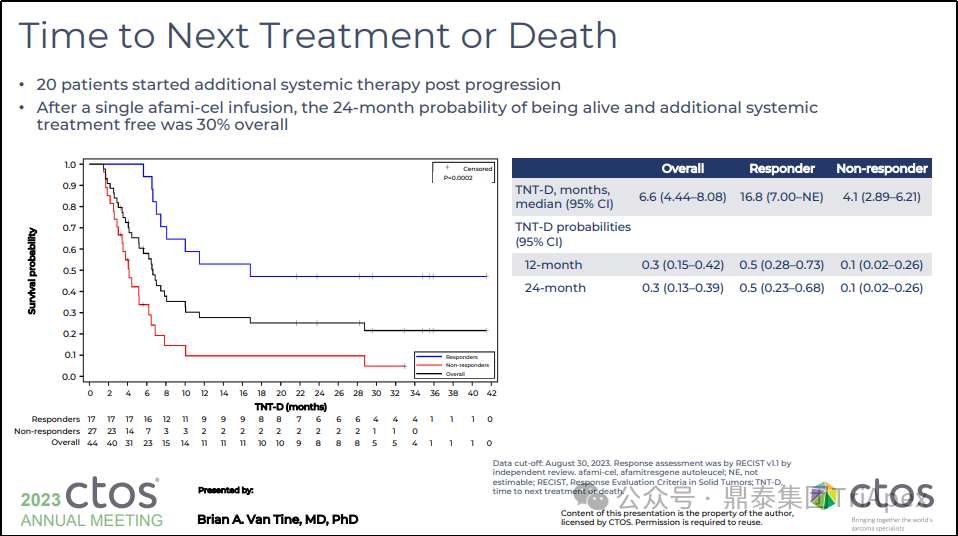
图31. SPEARHEAD-1(Phase 2,NCT04044768)下一步治疗和死亡
| OS
在数据截止时有 45.5% 的患者接受检查,中位 OS 为 16.9 个月(95% 置信区间:10.9-NE)
在 17 例滑膜肉瘤患者中,12 个月时 OS 率为 90%,24 个月时为 70%
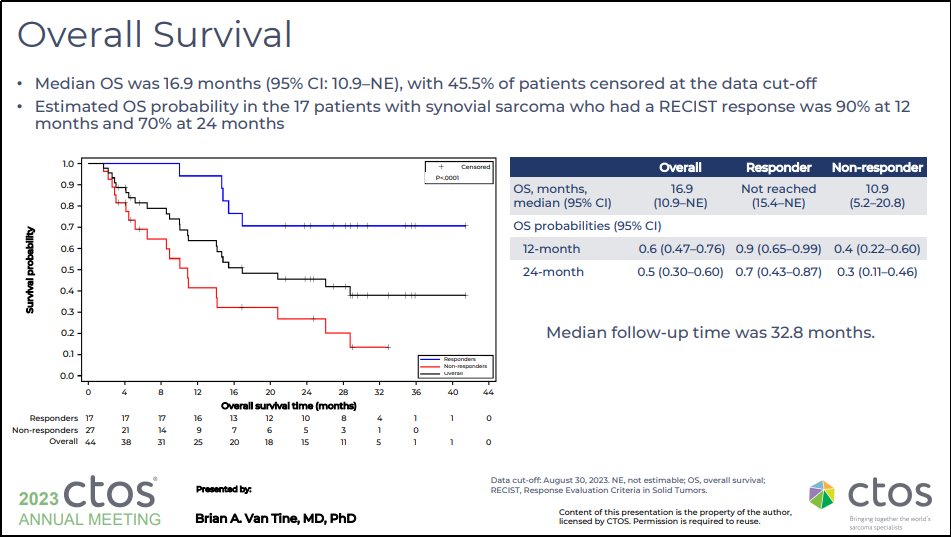
图32. SPEARHEAD-1(Phase 2,NCT04044768)OS
| 暴露量和 OS 的关系
暴露用 AUC0-3 来测量:输注后前 3 个月 Tecelra® 的浓度-时间曲线下面积(通过载体拷贝 /ugDNA 测量)
较高的 Tecelra® AUC0-3 与较长的 OS 相关;在 Tecelra® 暴露超过中位数的患者中,中位 OS 尚未达到
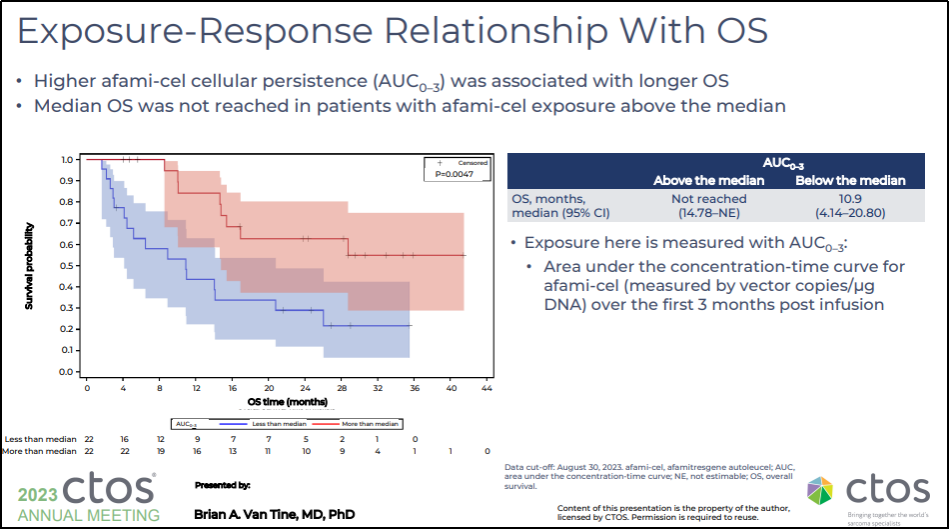
图33. SPEARHEAD-1(Phase 2,NCT04044768) 暴露反应和 OS 的关系
| Tecelra® 在全血中的存续时间(persistence)
所有患者输注后均检测到 Tecelra®,在大多数患者中,在评估的剂量范围内,在输注后的第一周观察到峰值;随后呈双指数(bi-exponential)下降;大部分患者中存续时间超过 600 天。在患者中 TCR-T 细胞峰值和存续时间存在巨大差异。
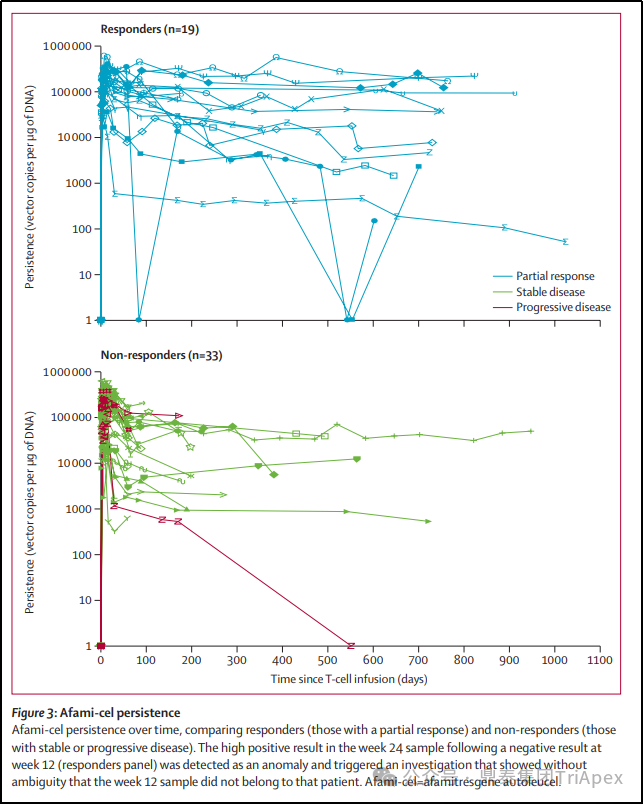
图34. Tecelra® 存续(persistence)
| 细胞因子和免疫细胞分型
对 Tecelra® 输注前后采集的换着血清样本进行了分析。在至少一半的数据集中,9 种生物标志物(41%)的浓度相较于输注前至少升高了 2 倍,如 GM-CSF、IL6、IFN-γ,其中 IFN-γ 的变化幅度最大;另一些生物标志物则表现出短暂性的小幅增加(如 TNFα)或可忽略不计的变化(如 IL-1β 和 TNFβ)。此外,研究发现发生 CRS 的患者中,输注后血清中 IFN-γ、IL-10、IL-15、IL-2Rα 和 IL-6 的浓度显著高于未发生 CRS 的患者。
对 30 名患者 Tecelra® 输注前采集的样本进行了免疫表型分析,重点关注 Tecelra® 中 CD3+ CD4+ 辅助性 T 细胞或 CD3+CD8+ 杀伤性 T 细胞的比例,以及表达 MAGE-A4 特异性 TCR 的比例。记忆亚群免疫表型分析表明,转导的 CD4+CD8-T 细胞主要是表达 CD45RA 的效应记忆 T 细胞和效应记忆细胞;T 辅助细胞具有相对较低的初始记忆(naive)或干细胞记忆(stem cell memory)和中央记忆性(central memory)T细胞。CD8+ CD4-T 细胞表现出相似的亚群分布,但效应记忆细胞的比例较低,同时初始 naïve 记忆或干细胞)记忆细胞和中央记忆细胞(central memory cells)的比例增加。
小结
Tecelra® 在用于治疗的晚期滑膜肉瘤患者治疗前需要进行预处理。
不进行额外全身治疗,24 个月生存概率为 30%。
在数据截止时有 45.5% 的患者接受检查,中位 OS 为 16.9 个月。
安全性:常见的不良事件包括 CRS 和血液毒性。
结语
以上内容为指导同类细胞治疗产品的非临床研究和临床开发提供了重要的参考价值。
值得注意的是,由于 TCR-T 抗原肽的多样化和分子设计的复杂性,具体产品的研究思路仍需要依据产品特征进行详细分析,并遵循相应监管机构的要求。综合运用多种体外试验手段(包括 in silico 分析、原发性或转染构建的细胞株等)评估供试品对抗原肽的交叉反应性或可能的脱靶效应;同时,充分利用特定的体内模型(如疾病动物模型)评估其在体内的存续情况、有效性特点和安全性特征。如可行,科学设计的整合性试验可能是必要的。此外,针对所采用的载体(特别是病毒载体)的针对性评价也是非常重要的。
后记:
2024年10月22日,星汉德生物自主研发的新一代 TCR-T 细胞疗法 SCG142 获 CDE 受理(此前已获得 FDA IND 批准)。鼎泰集团作为 SCG142 非临床研究的主要合作方对此表示衷心祝贺,并期待该产品能够更好地造福患者!
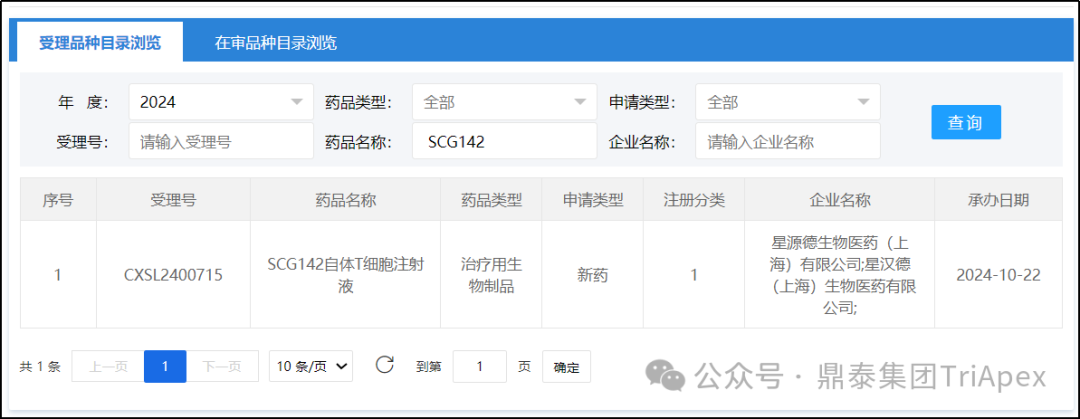
图35. SCG142 获 CDE 受理
参考资料:


































































































































