


妊娠状态的女性和具有生育可能的妇女(WOCBP)的用药安全性一直是工业界和监管机构共同关注的问题。近年来,随着众多抗体类药物的研发进入关键的Ⅲ期临床试验或上市申请阶段,对生殖毒性的评价成为非临床安全性研究的重点。
根据 ICH S6(R1) 和 ICH S5(R3) 指南,当非人灵长类动物(NHP)为唯一药理学相关种属时,建议通过一项“设计良好”的增强的围产期发育毒性(ePPND)试验进行风险识别。特别鼓励用于抗体类药物等生物制品的生殖发育毒性评估,而不推荐用于化学药物的研究。鉴于国内外的行业需求、研发现状和监管要求,建立经验证的抗体类药物 NHP ePPND 试验平台尤为紧迫。
基于上述背景,为科学识别和评估生物技术药物的生殖发育毒性风险,鼎泰集团生殖发育毒理中心立足于对指南、技术标准和相关案例的深度调研和理解,整合自身优势资源,创新技术体系,成功完成 某双抗项目食蟹猴 ePPND 试验(GLP)并建立了规范的、有竞争力的 NHP 生殖发育毒性研究平台。
本期内容结合 ICH 相关指导原则,对部分已上市抗体类药物 ePPND 试验研究案例进行了综述和解读,并分享本机构对于 ePPND 试验设计关键点、难点和挑战的理解,以及所制定的应对策略。同时,进一步对鼎泰集团 NHP 生殖发育毒性试验研究平台进行了介绍,期望为客户 ePPND 试验的开展提供更高水平的解决方案。
全文共:7779 字 33 图
预计阅读时长:20 分钟
文章导览
1 | ePPND 试验概述 |
2 | ePPND 试验设计关键点 |
3 | 案例(抗体类药物)给予的启示 |
4 | ePPND 试验的挑战及鼎泰的应对策略 |
5 | 鼎泰集团 NHP 生殖发育毒性研究平台简介 |
6 | 结语 |
01 ePPND 试验概述
ePPND 是一项结合了胚胎-胎仔发育毒性试验(EFD)和围产期发育毒性试验(PPND)终点的生殖发育毒性试验,其给药期贯穿整个妊娠期(如 GD20 到分娩)[1]。
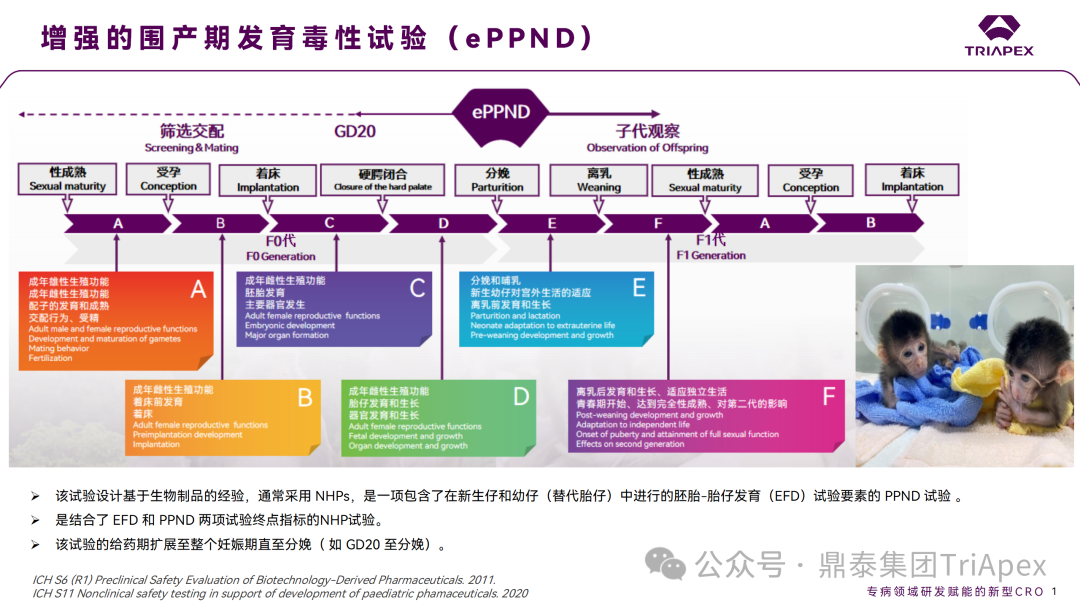
图1 生殖发育毒性各阶段评价重点及 ePPND 试验周期
| 适用范围
根据 ICH S5(R3)(2020)和 ICH S6(R1)(2011)[1-2] 等相关指南,ePPND 试验适用于仅在 NHP 中具有药理学活性的生物制品,在前期无相关文献资料足以证明其具有明确的生殖发育毒性时,评估其对生殖功能和发育过程的影响,从而起到限定临床研究受试者范围的作用,降低临床试验受试者和产品上市后适用人群的用药风险。
| 已上市抗体类药物 ePPND 试验开展情况
FDA 批准上市的 100 多个抗体类药物中,近 1/2 进行了生殖发育毒性相关试验(图2)。其中,24 个产品进行了 NHP ePPND 试验(表1)[3-8]。
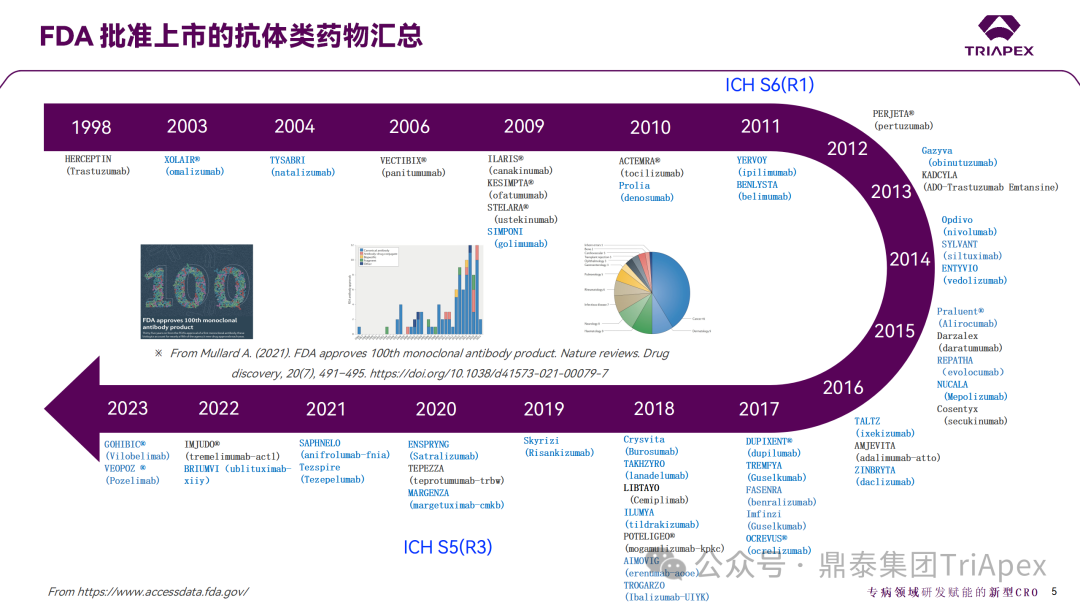
图2 FDA 批准上市的抗体类药物中进行了
生殖发育毒性研究的案例汇总(1998~2023)
表1 开展 ePPND 试验的抗体类药物汇总(截至2023年)
左右滑动查看
信息来源:https://www.fda.gov/drugs/development-approval-process-drugs/drug-approvals-and-databases
| ICH 指南对于开展 NHP 生殖发育毒性试验的策略要求
根据 ICH S6 (R1) [2],仅在 NHP 中具有药理活性的生物制品:
① 如果临床试验避孕措施充分,EFD 或者 ePPND 试验可以在Ⅲ期临床试验期间进行并在上市申请时提交完整报告。如在 Tezepelumab 的临床试验中,通过入排标准严格限定入组人群并使用高效的避孕方法进行风险控制,在上市申请时提交了 ePPND 试验完整报告。
② 当临床试验中不能采取充分的避孕措施时,申请人应该在Ⅲ期临床试验启动之前提交完整的 EFD 试验报告或者 ePPND 试验的中期报告(至少观察至 PND7)。如 Denosumab 因其适应症需要在临床试验中纳入 WOCBP,故申请人在Ⅲ临床前开展了 EFD 试验,并在上市后(因临床不良反应)补充了食蟹猴 ePPND 试验。
③ 如作用机制可能引发对胚胎-胎仔发育方面的严重担忧,无需在 NHP 进行发育毒性试验,即可将该担忧列入产品说明书,禁止 WOCBP 患者人群使用。如表2中案例7~20,均因预期可知的生殖发育毒性而未开展生殖发育毒性试验。
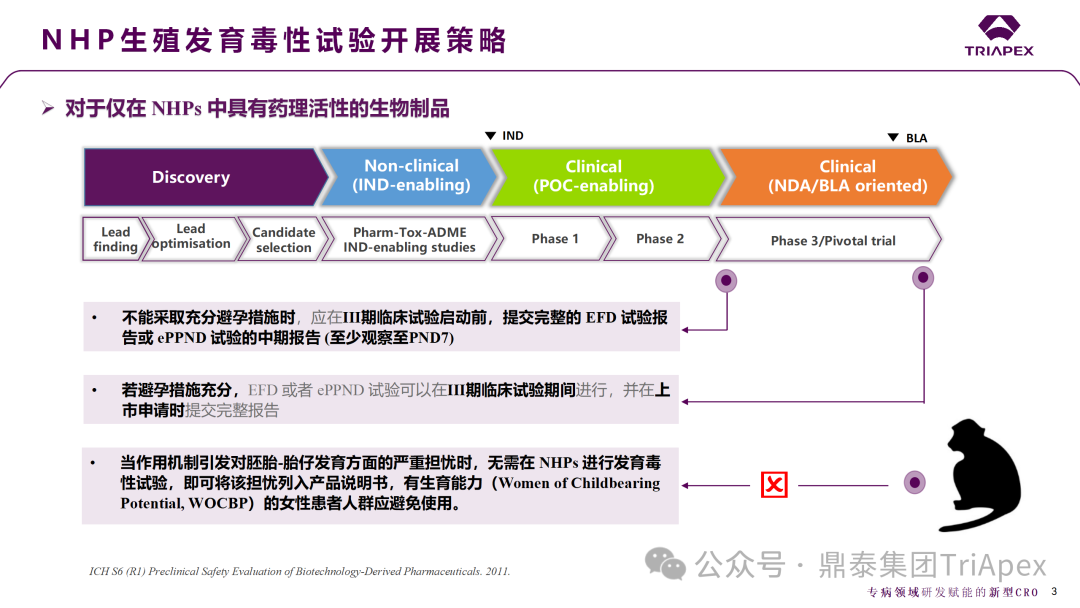
图3 ICH 及 NMPA 指南中关于生殖发育毒性开展策略
表2 已上市未开展 DART 试验抗体类药物
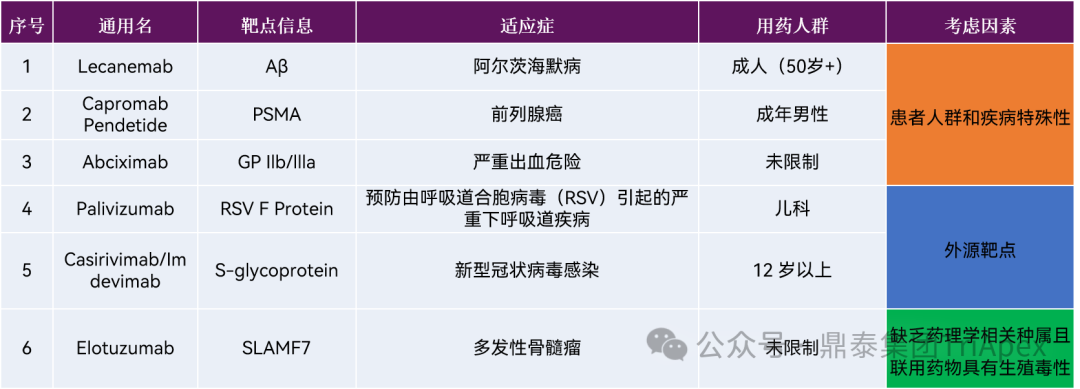
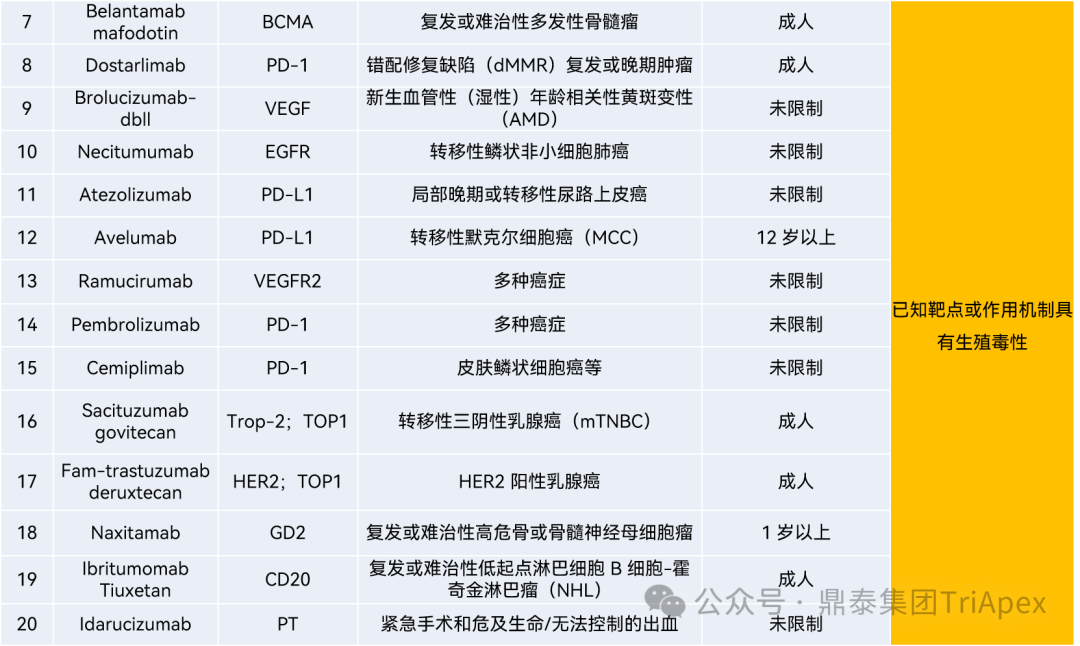
信息来源:https://www.fda.gov/drugs/development-approval-process-drugs/drug-approvals-and-databases
https://data.pharmacodia.com/
02 ePPND 试验设计关键点
| 基本要求
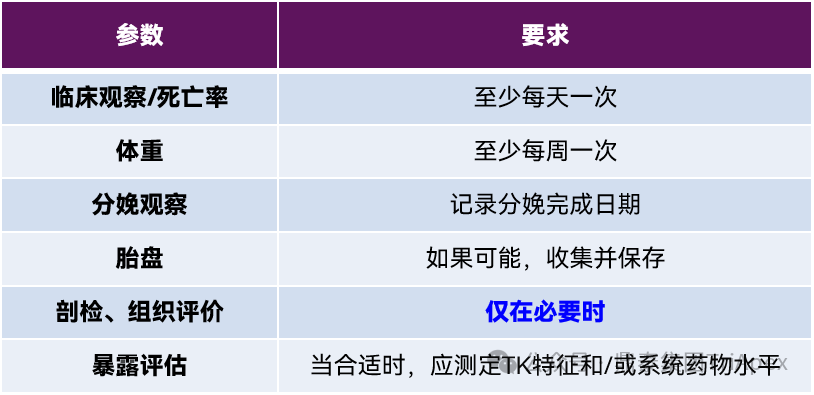
根据 ICH S5(R3)[1],对 F0 代和 F1 代的基本要求汇总如下:
· 动物数:约 16 只妊娠雌性/组
· 组别数:至少 2 组(包括1个对照组)
· 给药期:从确认妊娠(约GD20)至分娩
注释:如果使用食蟹猴以外的其他 NHP,试验设计应进行调整;其他 ePPND 试验中的每组妊娠动物数应能保证生产出足够数量的 F1 代,以便评估对妊娠结局的潜在不良影响,以及畸形和出生后发育,并在必要时提供进行特异性评价的机会(如免疫系统)。
F0代-妊娠动物
F1代-新生动物
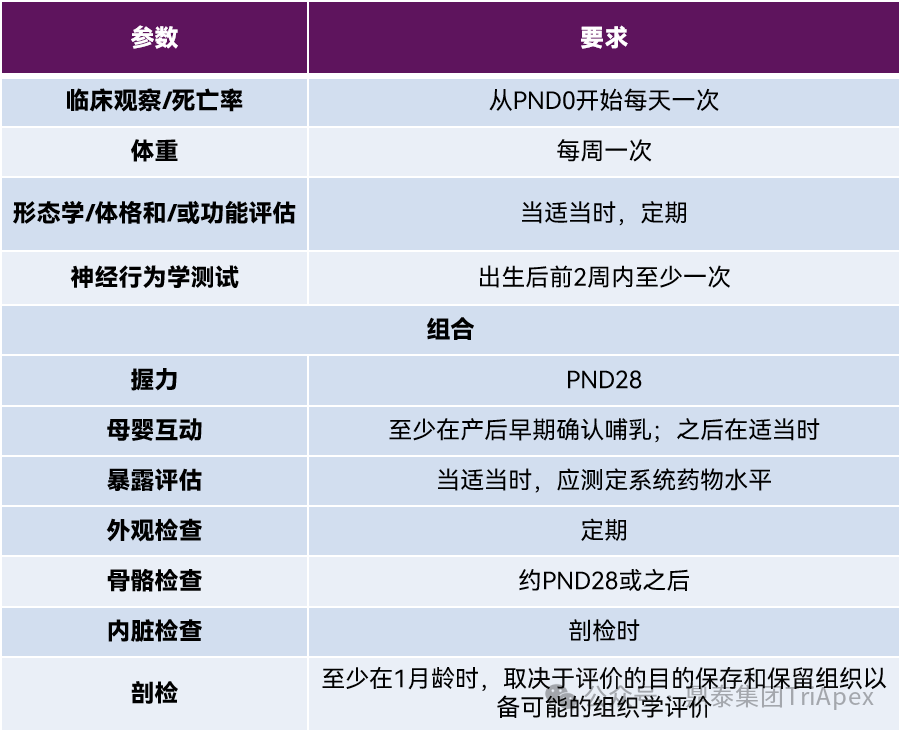
| 特殊考量
除 ICH 指南中要求的参数和指标,还应考虑到相关动物种属的特性和产品特征,如实验动物的生理特性,如受孕率、自然流产率、PND7 动物存活率等[9-11];FcRn 介导的抗体胎盘转运的潜在差异和暴露特点(图4);产品毒性监测的特殊指标(如免疫毒性);对于拟用适应症含有儿科人群的,需结合 ICH S11 的要求进行优化设计[12] ,如表3中的 Pozelimab,在 F1 代出生后约 90 天进行给药,考察对幼龄动物的发育毒性[13]。
生物制品具有生殖发育毒性潜力的物质基础非常关键。不同于小分子药物的被动扩散和异化扩散,大分子的胎盘转运往往受限,需要通过新生儿 Fc 受体(FcRn)和 Fc-γ-RⅢb 介导完成。具有生物学意义的胎盘转运主要发生在妊娠中晚期,对分子量大于 5000Da 的分子来说,整个器官发生阶段(GD20-50)的给药预计不会导致胚胎明显暴露,而免疫系统等的产前发育从 GD80 才开始。因此,经典的 EFD 研究设计可能不再适用于评估生物制品对胚胎-胎仔的潜在影响[14]。
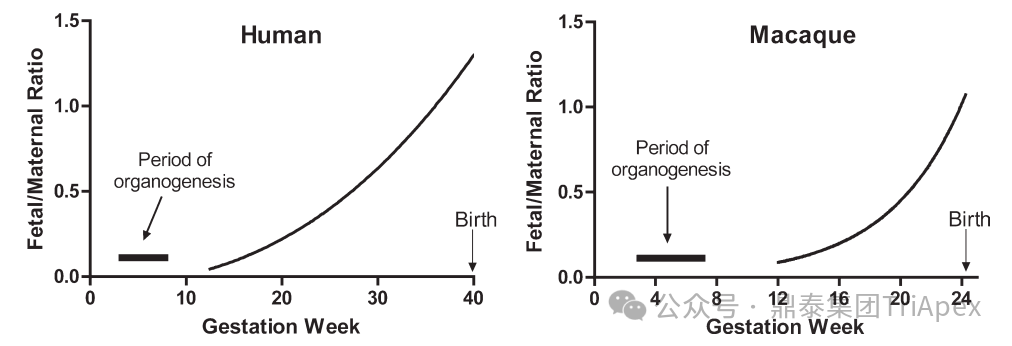
图4 猕猴和人类抗体胎盘转移主要发生在妊娠晚期[14]
| 鼎泰集团对案例的汇总
在学习和理解指南的基础上,鼎泰团队结合 ePPND 试验研究经验对相关案例进行了分析,并对具有代表性的 ePPND 试验设计案例和结果进行汇总(表3),如 Burosumab、Tezepelumab、Denosumab 等。
表3 已上市单克隆抗体药物食蟹猴 ePPND 试验案例总结
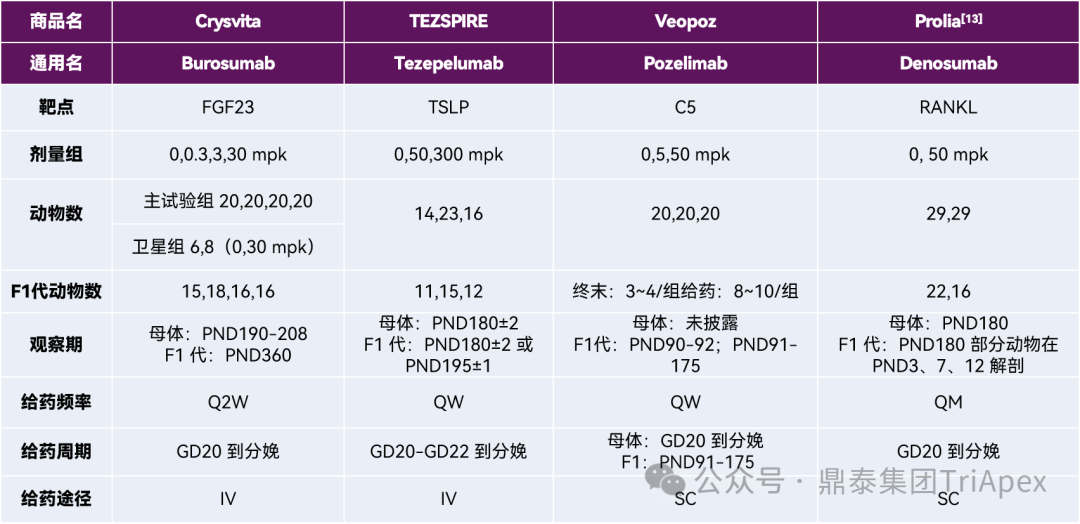
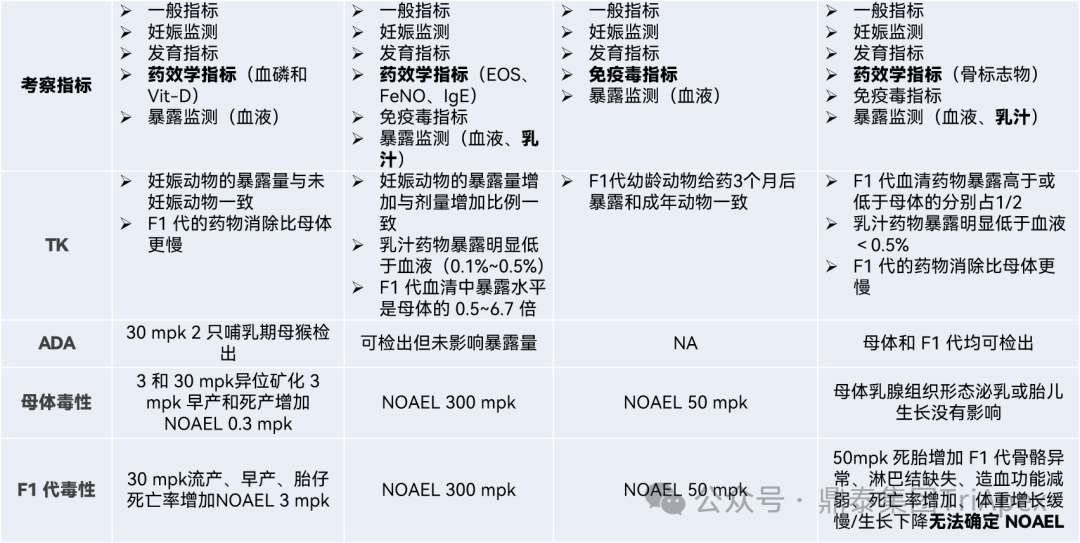
信息来源:https://www.fda.gov/drugs/development-approval-process-drugs/drug-approvals-and-databases
03 案例(抗体类药物)给予的启示
随着科学技术的进步和生物药研发进程的加快,相关指导原则和技术要求也在不断完善,如 ICH S5 于 2020 年从 R2 版本升级为 R3 版本。基于抗体类药物的靶点和预期风险,ePPND 试验的必要性和试验设计也有所不同。鼎泰团队在对相关案例进行汇总和分析的过程中,也收获了很多启示,将有助于鼎泰集团更好地规划未来的研究工作,进一步完善生殖发育毒性试验平台,确保 NHP ePPND 试验的顺利展开。
◆ 研究设计与实施的关键点
长周期动物饲养管理
动物合笼计划安排
室内自发流产因素分析
剂量设计考量
组别、动物数、给药途径、观察周期、观察终点、药物暴露和指标监测等
◆ 交配动物筛选时的考虑因素
年龄、体重
健康状态
生育能力
雌猴月经周期判断
合笼配比优化方案
◆ 妊娠动物的监护
妊娠期连续监控
胚胎发育健康状态判断
流产情况处理和动物护理方案
母体毒性监控和处理(如超敏反应)
产前评估诊断策略
产后护理策略
◆ 特殊情况处理和应对措施总结
剖腹产F1代的饲养管理
早产F1代饲养管理
弃养动物的饲养管理
行为指标采集及异常判定
发育指标采集及异常判定

04 ePPND 试验
挑战及鼎泰的应对策略
由于 ePPND 试验的特殊性,在试验开展的各个阶段都存在一定的难度和挑战,基于本机构开展的某双抗项目食蟹猴 ePPND 试验经验,对过程中的实施和应对策略汇总如下:
| 动物筛选
对雌性动物进行月经周期筛查和对雌雄动物进行体况评分等,有效提升交配成功率。
| 自然流产判断
当 GD50 前出现流产或妊娠终止,考虑到此时胎盘转移效率低、自然流产率背景高,以及确保达到试验目的等,及时增补动物。
| 剖宫产评估
基于 B 超诊断技术识别难产风险,采取剖宫术和人工助产,有效保障了 F1 代成活率。

图5 通过 B 超诊断技术进行妊娠监控(胚胎发育及胎位不正;来源于鼎泰集团背景数据)
| 人工哺育
对剖宫产及被弃养的仔猴进行人工哺育至观察期结束,未发生因人工哺育不当导致的动物死亡或异常。

图6 人工哺育 F1 代食蟹猴(来源于鼎泰集团背景数据)
| 动物福利及驯化
对于幼龄动物发育指标的数据采集,除了采血和人为测量外,还有各种功能组合测试,如精细运动测试、握力测试、行为学功能测试等,对动物进行适应和奖励驯化(如图7)。

图7 F1 代食蟹猴食物偏好的观察(来源于鼎泰集团背景数据)
| F1代评估
在精细运动、握力、行为学等数据采集和评估时,考察了不同饲养方式等带来的混杂因素和产生的差异。
| 结果解读
在该试验中,供试品引起了放大的药理作用和超敏反应。研究团队及时进行干预,并对干预结果和影响进行了科学评估。
目前,鼎泰集团已通过大量样本试验和验证,掌握相关操作要领,积累了宝贵的应对经验,并形成标准操作规程(SOP)和应对策略,保障技术实施的科学性和合规性。
05 鼎泰集团
NHP 生殖发育毒性研究平台
-- 团队经验和背景数据 --
平台拥有超过 15 年以上安评经验的毒理专题负责人,20 年以上专注从事 NHP 动物试验的兽医,并且与教育部重点实验室深度合作。在生物技术药物非临床安全性评价方面以及剖宫产手术、人工哺育、行为学等重难点方面的经验丰富。已形成 NHP 动物生殖发育毒性试验相关 SOP、管理制度及特殊情况应对策略等。
目前,鼎泰集团已完成 NHP 生殖发育毒性评价中心的建立和体系搭建,正开展一项双特异性抗体的食蟹猴 ePPND 试验,获得了丰富的背景数据、实践和风险应对经验。

ePPND设施和设备
鼎泰集团建设 5000 m2 GLP 动物饲养设施,用于开展 NHP 生殖发育毒性评价试验。配备现代化的育婴室、剖宫产手术室、行为功能测试室、学习和记忆测试室等,各种巧妙设计的笼具、饲养室和动物福利管理(自2012年首次通过 AAALAC 认证并连续多次复查通过,获得国际知名客户的审计认可),为高质量的实验动物数据获得提供保障。


高品质非人灵长类实验动物供应链
鼎泰集团拥有自主稳定的高品质 NHP 实验动物资源供应链,分别为昆明亚灵生物科技有限公司(下称“昆明亚灵”)和海南亚灵生物科技有限公司(下称“海南亚灵”)两个非人灵长类动物饲养繁殖基地。

昆明亚灵
成立于 2006 年,按照国际标准建立。于 2011 年首次获得国际组织 AAALAC 完全认证,迄今已连续五次通过该组织每三年1次的复审。目前拥有非人灵长类动物检疫、饲养、繁殖和疾病模型研究设施 15200 m2,拥有繁育群、疾病模型群和 SPF 群等不同类型的动物资源。在国内率先建立了非人灵长类动物养殖管理及实验信息数据库,一直以来都被同行及国家各级行业主管部门视为标杆企业,所生产的实验动物已经被国际多家生物医药研究机构广泛使用。



海南亚灵
成立于 2021 年 11 月,位于海南省文昌市,总建筑面积 48000㎡,已建成规模在国内领先的4-6岁高品质食蟹猴繁殖种群。

06 结语
在众多生物技术药物逐步推进至关键性临床的背景下,ePPND 试验具有迫切的行业需求。高质量的 ePPND 试验需要高标准的设计、长周期的持续投入、稳定的供应链保障。鼎泰集团深刻理解 ePPND 试验的适用情景,通过紧密结合产品特点和风险预估,并与国内外监管机构保持同步,确保对最新法规和技术要求的全面遵循。
我们从技术要求和试验目的出发,深度解读相关指南和案例,成功将这些知识应用于平台优化和抗体类药物的非临床安全性评价研究中。通过对 ePPND 试验设计关键要点和难点进行深度理解,精准把握技术优化的方向,使通用设计灵活适应个性化检查和检测需求。
通过 GLP 机构与昆明亚灵/科灵的紧密联动,鼎泰集团打造了具有领先优势的 ePPND 研究平台,充分利用 NHP 资源供应链、设施环境、动物福利、设施、设备、GLP 管理以及丰富的人员经验,为 NHP 生殖发育毒性研究的规范开展提供了可靠保障。目前,鼎泰集团已具有承接 NHP 生殖发育毒性试验(含ePPND)的完备能力,致力于为合作伙伴提供高质量赋能服务。
参考资料:


































































































































