


在为寡核苷酸药物开发提供服务的过程中,我们经常接到客户的咨询:寡核苷酸药物的免疫原性是否有必要评估?如果要做,应该怎么做?做到什么度?今天,我们为您揭晓……
全文共:7334 字 32 图
预计阅读时长:25 分钟
美国时间2024年10月7日至2024年10月8日,由美国食品药品监督管理局(FDA)及复杂仿制药研究中心联合举办的“Scientific and Regulatory Considerations for Assessment of Immunogenicity Risk for Generic Peptide and Oligonucleotide Drug Products”主题研讨会成功举行。本次研讨会旨在汇聚工业界、学术界和监管人员,共同探讨 Peptide 和 Oligonucleotide 治疗产品免疫原性风险评估相关的科学和监管挑战。研讨会主要讨论内容如下:

我们已经打包整理会议相关的PPT和视频材料,如有需要可联系小编获取。
鼎泰团队结合行业需求和团队经验,着重对研讨会中涉及的寡核苷酸药物的免疫原性相关议题进行了深入学习和调研,并汇总了已上市寡核苷酸药物的免疫原性信息,以期指导后续非临床和临床阶段免疫原性分析工作。
★ 文章导览★
01 | 研讨会学习:寡核苷酸药物免疫原性风险的监管考虑 关键词:寡核苷酸;免疫原性;监管视角 |
02 | 案例回顾:已上市寡核苷酸药物的免疫原性 关键词:阳性率;ADA检测方法;中和抗体 |
03 | 鼎泰寡核苷酸药物免疫原性分析经验和技术储备 |
Workshop Content about the Immunogenicity of Oligonucleotides
研讨会学习:寡核苷酸药物免疫原性风险
的监管考虑
研讨会上来自转化与精准医学部临床药理学办公室(Division of Translational and Precision Medicine, Office of Clinical Pharmacology)Bart Rogers 博士介绍了 FDA 对于寡核苷酸药物免疫原性风险监管和监督的基本考虑。本节对报告主要内容进行梳理,并加入了鼎泰集团生物分析团队深入学习后整理的学习笔记。
What are RNA Oligonucleotides
什么是 RNA 寡核苷酸

图1. RNA 寡核苷酸药物特点
RNA 寡核苷酸的特点:
通常设计为与目标 RNA 互补配对的核酸片段
通过 Watson-Crick 碱基配对作用产生药效
通常存在特殊修饰以提高特异性、减缓消除
多种修饰方式:针对骨架(phosphorothioate、morpholino),2'端(Floyoro、MOE、cEt)
鼎泰团队学习笔记
寡核苷酸药物通常由化学合成的短链 RNA 或 DNA 组成(目前批准上市的药物约为 20-40 mer),与目标 RNA 配对结合后,利用内源性核酸酶降解目标 RNA 或通过立体阻断核糖体机制调节 RNA 剪接和翻译过程,从而达到治疗疾病目的。寡核苷酸药物通常由化学合成制备,但分子量较大,作用机理较传统化学小分子机理复杂,并涉及特定的代谢和免疫途径。
寡核苷酸安全工作组(OSWG,Oligonucleotide Safety Working Group)根据寡核苷酸分子结构特点和递送方式对已经批准和在研的产品归类划分为不同的平台(如图2),相同平台生产的寡核苷酸在分子结构、序列长度、化学骨架、化学修饰、偶联物和/或制剂处方方面有相似的性质[1]。
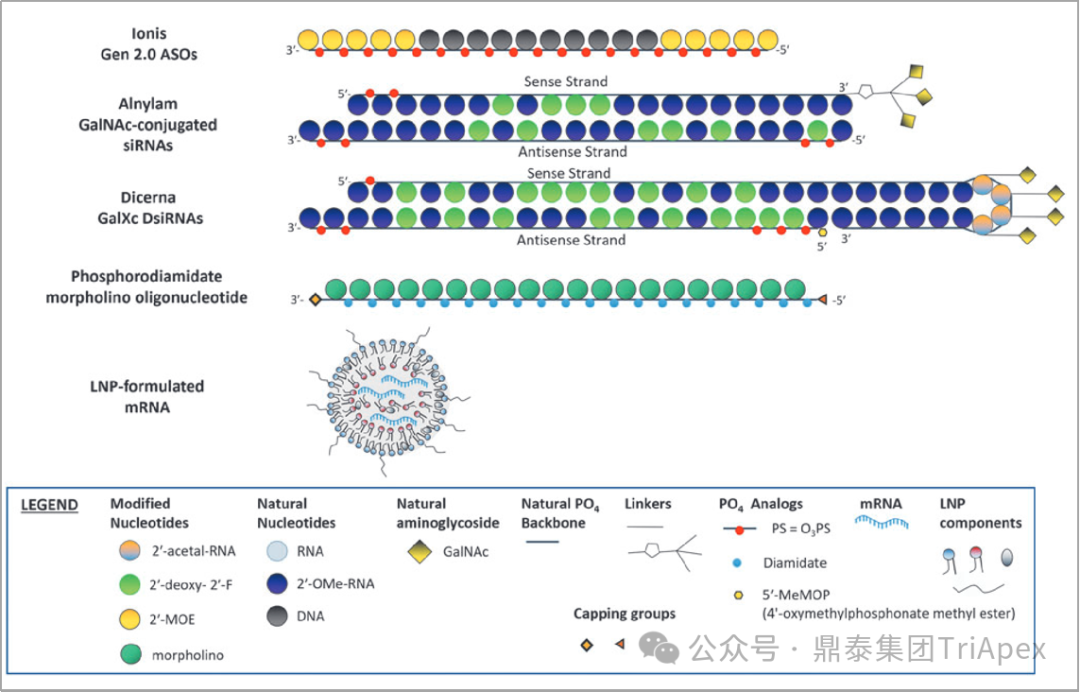
图2.常见的寡核苷酸平台
Why is RNA Oligonucleotides
为什么选择 RNA 寡核苷酸
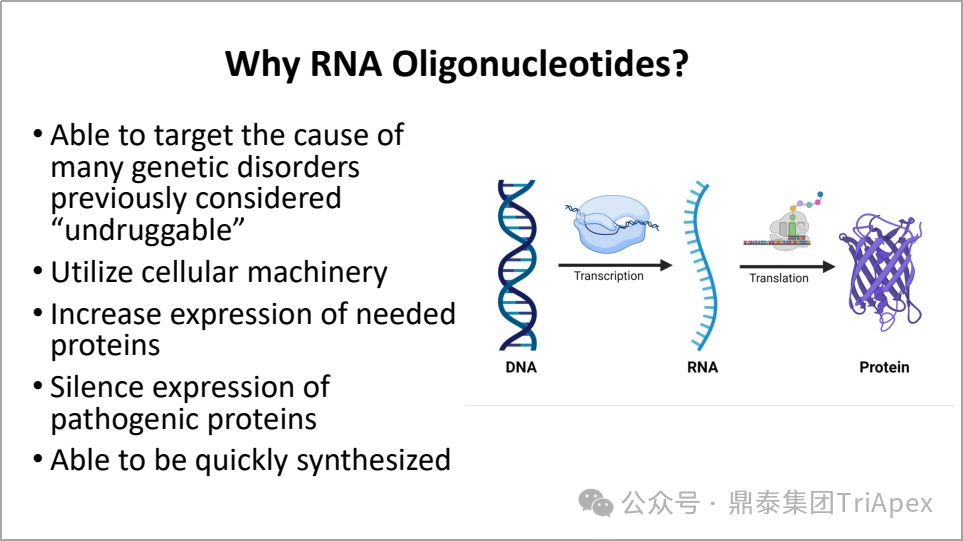
图3. RNA 寡核苷酸药物优势
寡核苷酸产品的潜在优势:
能靶向许多过去被认为“不可成药”的遗传疾病的致病基因
利用细胞自身的机制发挥药效
增加所需蛋白的表达
抑制致病蛋白的表达
可快速合成
The origin of oligonucleotide toxicity and its relationship with immunogenicity
寡核苷酸药物毒性来源及其与免疫原性的关系
◆ 杂交依赖型脱靶安全性风险由 Watson-Crick 碱基杂交介导
在非靶标动物模型中难以评估,需要通过替代分子或者基因编辑小鼠模型进行研究
采用生物信息学方法评估(如:BLAST、bowtie)
◆ 非杂交依赖型脱靶安全性风险
先天免疫介导:对单链 RNA、单链 DNA、双链 RNA 和双链 DNA 的不同识别
Toll 样受体激活
干扰素激活
是否具有剂量/暴露依赖性
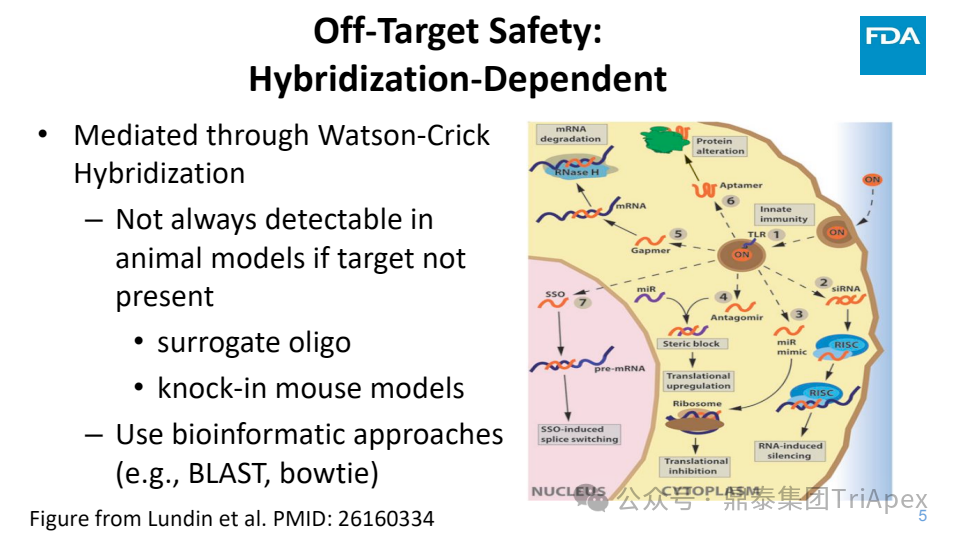
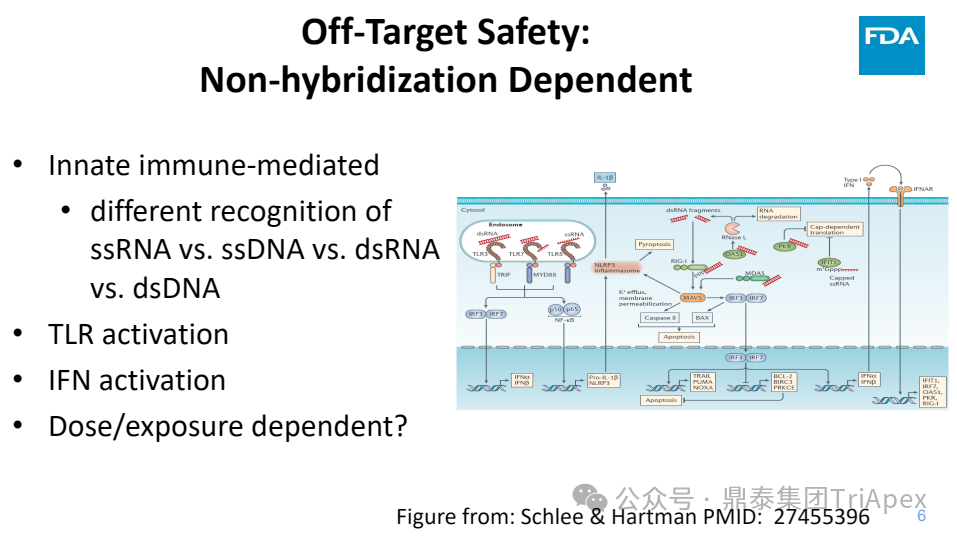
图4. 寡核苷酸药物安全风险
FDA Approved RNA Oligonucleotides
FDA 批准的 RNA 寡核苷酸药物
截至 2023 年 FDA 批准的 RNA 寡核苷酸药物已有 17 款(截至发文时,该数字进一步提高为 22 个)。
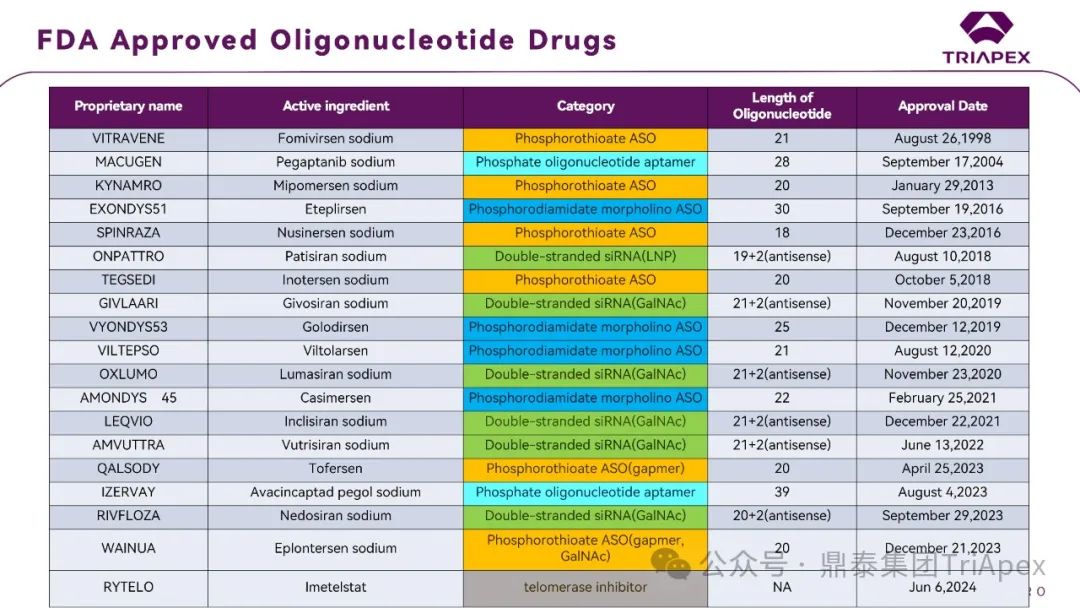
图5. FDA 批准上市的的寡核苷酸药物(截至2023 年)
Immunogenicity of FDA Approved Oligonucleotides
FDA 已批准寡核苷酸药物免疫原性经验汇总

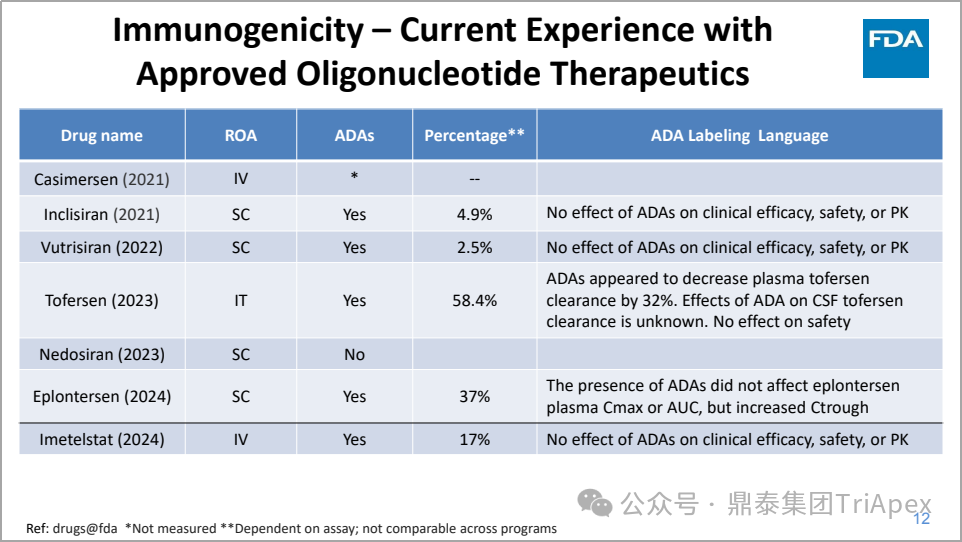

图6. FDA 批准寡核苷酸药物免疫原性汇总
对疗效或安全性没有明确影响,对药代动力学(Ctrough)的有限影响
抗药物抗体(ADA)的产生通常发生在多次给药后,在某些情况下是一过性的
最佳采样时间可能取决于寡核苷酸疗法的化学类别
White Paper and Guidance About the Immunogenicity of Oligonucleotides
寡核苷酸药物免疫原性相关白皮书及指南
◆ OSWG 2022 年发表了关于寡核苷酸药物免疫原性评估的相关建议[2]
文章概述了寡核苷酸药物免疫原性评估策略,指出其整体免疫原性风险较低,但需结合药物结构、递送系统和临床数据系统监测 ADA,以平衡药物开发的安全性和有效性。

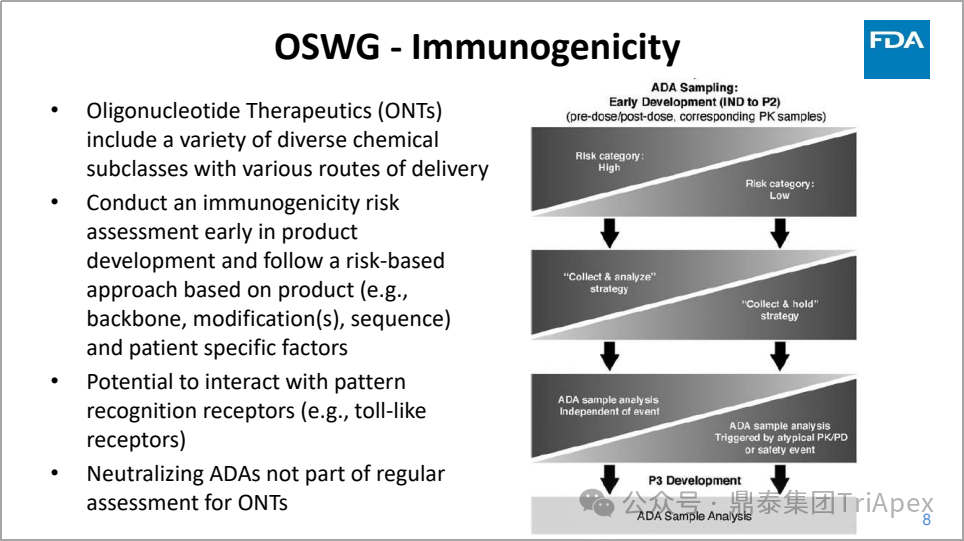
◆ FDA 于 2024年6月发布的《Clinical Pharmacology Considerations for the Development of Oligonucleotide Therapeutics》[3]
对该类药物的免疫原性风险评估给出了指导性建议

鼎泰团队学习笔记
◆ Advances in Nucleic Acid Therapeutics(2019)[4]
本书 20.6.2 章节系统性介绍寡核苷酸药物给药后对机体先天免疫和适应性免疫产生的免疫作用。
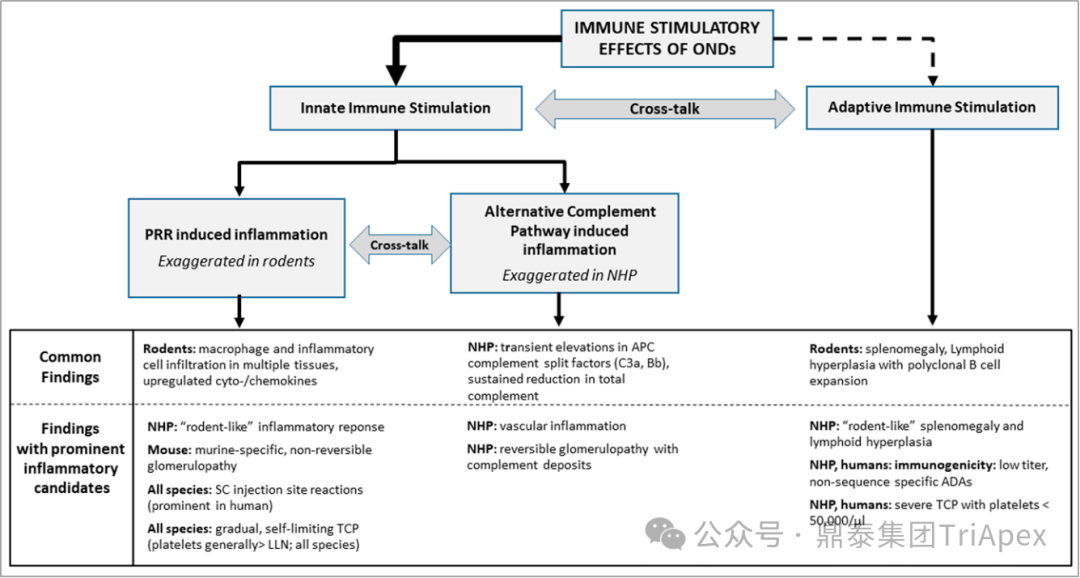
图7. 寡核苷酸药物的先天免疫和适应性免疫
◆ Considerations in the Immunogenicity Assessment Strategy for Oligonucleotide Therapeutics (ONTs)(2022)[5]
文章强调应精心设计临床免疫原性评估策略,以便在产品开发过程中准确、适当地监测潜在的免疫原性,并将其风险降至最低。本文从产生免疫原性的因素、试验设计,样品采集、分析方法等方面介绍寡核苷酸药物的免疫原性。
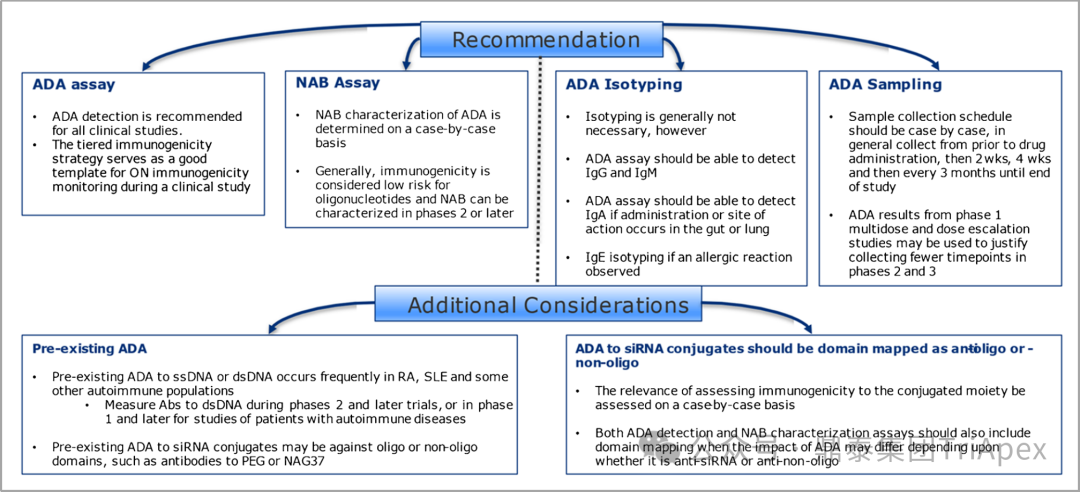
图8. 寡核苷酸药物免疫原性分析策略
◆ 2022 White Paper on Recent Issues in Bioanalysis: FDA Draft Guidance on Immunogenicity Information in Prescription Drug Labeling, LNP & Viral Vectors Therapeutics/Vaccines immunogenicity, Prolongation Effect, ADA Affinity, Risk-based Approaches, NGS, qPCR, ddPCR Assays[6]

图9. WRIB 白皮书中寡核苷酸药物免疫原性评估建议
2022 年 WRIB 工业界对寡核苷酸药物免疫原性评估给出如下建议:
可使用基于平台的数据和文献进行免疫原性风险评估
根据评估风险较低的寡核苷酸药物,可先将非临床和Ⅰ期/首次用于人体(FIH)研究的样本储存起来,以备后续需要时再进行检测。若无临床信号,无需检测抗双链 DNA 抗体、中和抗体(NAbs)以及抗药物抗体(ADA)的亚型
若无法获得亲和纯化的阳性对照(PC)抗体,可使用总 IgG 或免疫动物的血清作为阳性对照(测定相对浓度)
◆ OSWG Recommended Approaches to the Nonclinical Pharmacokinetic (ADME) Characterization of Therapeutic Oligonucleotides(2023)[1]
OSWG 在本文中对寡核苷酸药物免疫原性给出如下建议:
参考 ICH S6(R1) 和 FDA 免疫原性指南中对生物制品的原则及 OSWG ADA 小组委员会的建议基于风险的考虑进行寡核苷酸药物 ADA 的评估
从对 PK、PD 或毒性的变化解释的影响评估 ADA 检测必要性
分析方法和收集样本的时间应根据观察到的数据、研究的类别(包括给药机制)、给药途径和频率、患者群体的紧迫性等确定
◆ Cross‐Reactive Polyclonal Antibodies Raised Against GalNAc‐Conjugated siRNA Recognize Mostly the GalNAc Moiety[7]
本文通过动物免疫产生了抗 GalNac-siRNA 多克隆抗体,通过试验证明可以用作同类 GalNAc- siRNA 的免疫原性试验阳性对照。
Immunogenicity Assessment
免疫原性评估


图10. FDA 对寡核苷酸药物免疫原性评估汇总
在开发早期制定免疫原性评估计划,在对关键性临床试验样本进行测试之前验证分析方法并提交报告
如果化合物被认为风险较低,免疫原性评估可以推迟到后期开发阶段
如果寡核苷酸药物免疫原性风险较低且化学性质在之前已批准的项目中已有研究基础,可以采用“收集并保留”策略
给药方式可能改变免疫原性风险
考虑分析方法灵敏度/特异性影响 ADA 对 PK、PD 和安全性的解释
具有免疫调节作用的寡核苷酸药物(例如 CpG)可能需要以不同的方式评估(例如,动物研究可能提供有关预期和非预期效应的信息)
鼎泰团队学习笔记
寡核苷酸药物给药后机体会对载体、骨架、核酸序列或药物整体产生免疫反应。在产品开发早期可基于产品风险参考 FDA 治疗性蛋白产品免疫原性评估指南[8]对寡核苷酸药物非临床和临床免疫原性进行评估。FDA 指南《Clinical Pharmacology Considerations for the Development of Oligonucleotide Therapeutics》[3]建议在对寡核苷酸药物进行免疫原性风险评估时,需将以下因素纳入考量范围:
产品因素:碱基序列、碱基修饰、骨架修饰、绞合度(strandedness)、纯度、修饰后的核苷酸、二级和三级结构、载体成分(如 PEG 化脂质纳米颗粒)以及肽或抗体等载体
产品的药理学作用:作用机制、细胞/组织靶点、靶点表达谱、给药途径、给药方案
患者特征:人群的免疫激活状态(如自身免疫或炎症状况)、可影响 ADAs 发生率或临床后果的合并用药(如化疗等免疫抑制剂)
Immunogenicity Consideration
免疫原性考量

图11. FDA 对寡核苷酸药物免疫原性分析的考虑
早期阶段、单剂量、短周期的研究中 ADA 发生风险较低
“收集-保留”与“收集-检测”策略的选择
早期分析方法的开发与验证至关重要
挑战性高的中和抗体分析方法必要性不高
Immunogenicity Best Practices
免疫原性评估最佳实践

图12. FDA 对寡核苷酸药物免疫原性检测的建议
鼎泰团队学习笔记
FDA 《Clinical Pharmacology Considerations for the Development of Oligonucleotide Therapeutics》[3]指南建议:
FDA 发布的《治疗性蛋白产品的免疫原性检测》(2019年2月)[8]指导原则中多层级免疫原性检测适用于寡核苷酸药物免疫原性评估
若寡核苷酸药物包含载体成分(例如聚乙二醇化脂质纳米颗粒)和/或与蛋白靶向配体(例如抗体片段),则开发多种免疫原性检测方法来测量对不同成分的免疫反应
某些寡核苷酸药物的作用机制会产生修饰蛋白(例如改变剪接、外显子跳跃的寡核苷酸疗法),针对修饰后蛋白的 ADA 检测需要考虑
如下类型的产品需要进行先天免疫激活评估:寡核苷酸药物会诱导的细胞因子释放、存在已知在人类中具有免疫刺激作用的序列(如GU、CpG 或 5’-P)、存在具有 2’-脱氧、2’-OH 或未甲基化C 的天然核苷酸
临床免疫原性评估中,建议样本收集应与 PK 和 PD 采样时间点匹配,以评估 ADA 对 PK/PD 的影响
Concerns Over the Impurities Immunogenicity
对杂质免疫原性的担忧

图13.寡核苷酸药物中杂质的免疫原性考量
杂质包括可能具有免疫原性的单个碱基变异
对于杂质免疫原性分析方法的开发和验证非常重要
鼎泰团队学习笔记
对于核苷酸仿制药物,如果活性分子相同,则剩余的不确定因素大多数是由杂质引起的,杂质可以改变免疫反应的程度和性质。
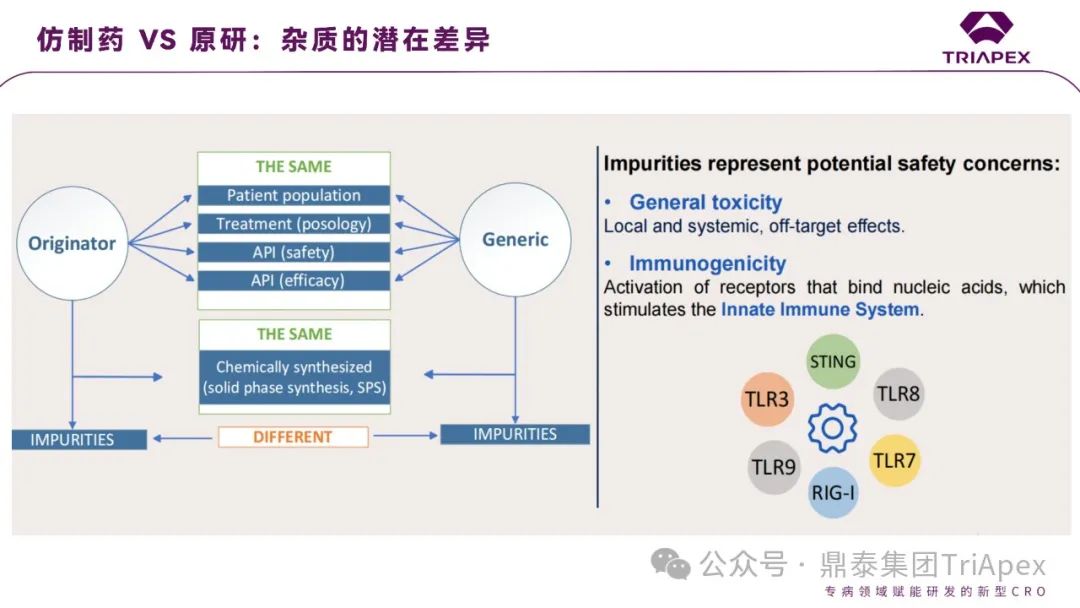
图14. 原研和仿制寡核苷酸药物的差异比对
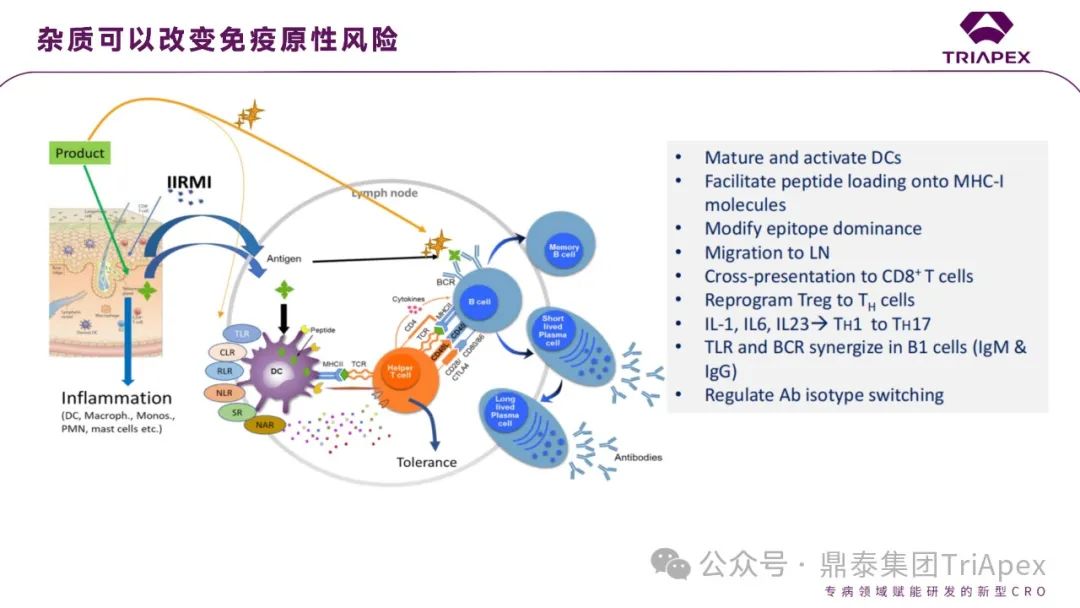
图15. 寡核苷酸药物杂质导致免疫原性风险
寡核苷酸药物不同于多肽类产品,确认其是否含有先天免疫反应调节杂质(IIRMI)是关键。需要基于检测目的,建立合适的分析方法。方法的关键信息包括:灵敏度、特异性、精密度、合适的质控、接受标准、可行性等。
Immunogenicity of Approval Oligonucleotides
上市寡核苷酸药物的免疫原性
已公布的寡核苷酸药物的免疫原性信息显示,ADA 发生率分布从非常低到很高(4%~72%),但对临床疗效或安全性的影响有限。目前已获得数据表明,寡核苷酸药物普遍具有较低的免疫原性风险,对 PK、PD 和安全性尚未发现较大影响。下面是3个已批准寡核苷酸药物资料中免疫原性的案例。
Onpattro™(patisiran) Case Study
Onpattro™(patisiran)药物案例研究
Onpattro™(patisiran)是一种脂质复合物注射液,将 siRNA 包裹在脂质纳米颗粒(LNP)中,分子量约为 14kD,静脉输注后递送至肝脏细胞内,靶向 TTR mRNA 以抑制 TTR 的产生。2018年获得 FDA 批准用于治疗成人遗传性甲状腺转体介导的淀粉样变(hATTR),是首个获批的 siRNA 治疗药物(关于临床开发路径,点击详见往期文章)。
临床前 9/60 和 25/60 动物检测到抗 PEG IgM 和 IgG
在安慰剂对照的临床研究中,约 4.1% 的 patisiran 治疗患者(6/148)显示 ADA 阳性,但 ADA 滴度较低且持续时间短,因此未进行中和抗体检测。数据显示未见 ADA 对 Patisiran 的临床疗效、药代动力学或药效学特征产生影响,属于低风险产品[9]
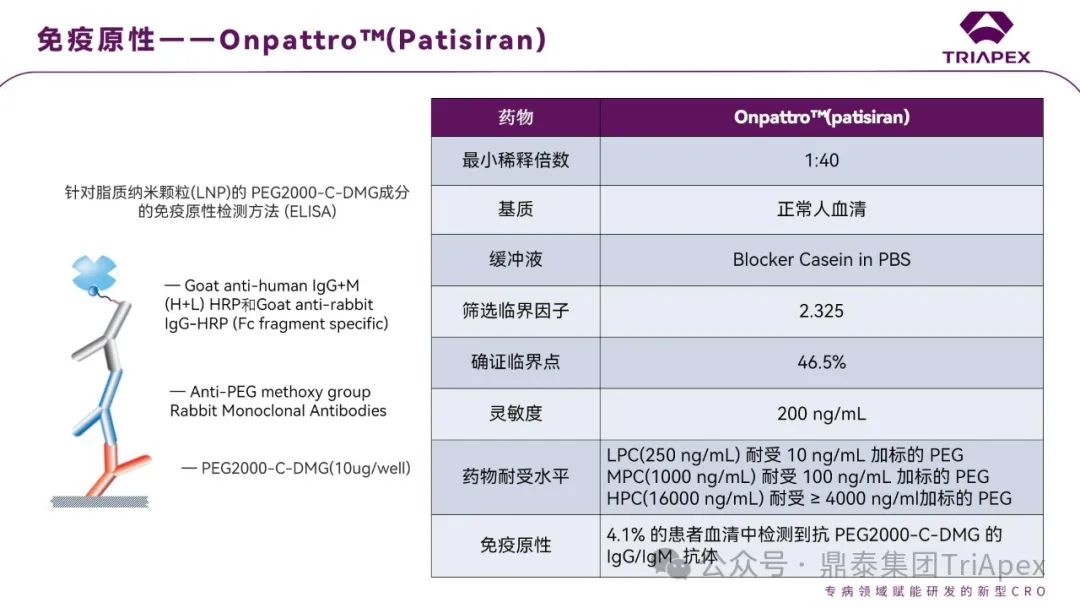
图16. Onpattro™(patisiran)ADA 方法和验证参数汇总
Spinraza® (nusinersen) Case Study
Spinraza® (nusinersen)药物案例研究
Spinraza® (nusinersen)是一种含有 18 个碱基残基的硫代反义寡核苷酸,可修饰 SMN2 基因的前信使 RNA 剪接,从而促进全长 SMN 蛋白的产生。2016年获得 FDA 批准,腰椎穿刺鞘内给药,用于治疗儿童或成年患者脊髓性肌萎缩症(SMA)。
临床研究中共 5 例(4%)患者检测出 ADA 阳性,其中 4 例是短暂和 1 例是持久性的(滴度较低且呈现滴度下降)。所有阳性样本的滴度范围为 1 至 16
由于中和活性的主要风险来自高滴度持续的 ADA,考虑到 ADA 的发生率、滴度和 ADA 的整体短暂性,因此未进行中和抗体检测。Spinraza 寡核苷酸的独特结构具有诱导 ADA 与 dsDNA 交叉反应的可能,临床研究中未进行 Spinraza® 对 dsDNA 的交叉反应性的评估
基于上述,FDA 要求在上市后评估 ADA 阳性样品中 dsDNA 的交叉反应性。免疫原性检测方法采用过氧化物酶偶联的重组蛋白 A/G 为检测抗体,蛋白质 A/G 主要结合人类 IgG,因此实际的 ADA 发生率可能比报道的要高或发生得更早[10]。
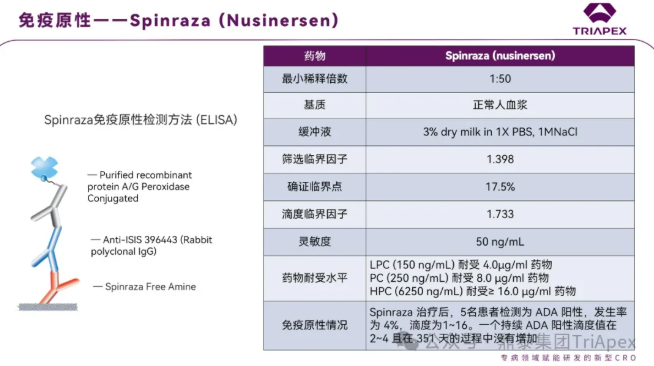
图17. Spinraza (nusinersen) 检测方法和验证参数汇总
Oxlumo®(Lumasiran)Case Study
Oxlumo®(Lumasiran)药物案例研究
Oxlumo®(Lumasiran)是一种皮下注射的合成 siRNA,与 GalNAc 配体结合,可抑制羟基酸氧化酶1(HAO1)基因的 mRNA。2020 年获得 FDA 批准用于治疗儿童和成人患者的原发性高草酸尿症1型(PH1)(关于临床开发路径,点击详见往期文章)。
采用经验证的 ELISA 法检测人血清中抗 Lumasiran IgG/IgM 抗体。该方法可以检测抗 GalNAc 抗体、抗双链 siRNA 抗体和连接体抗体。方法灵敏度为 65.6 ng/mL,MRD 确定为1:50。样品检测中直接对筛选 ADA 阳性样品进行 ADA 滴度检测。
在 Lumasiran 开发项目的所有临床研究中,包括 PH1 患者和健康志愿者,100名 Lumasiran 治疗个体中有6名(6%)早在 D29 检测出 ADA 阳性
在研究 001B/002 中,3例患者报告 ADA 阳性,但随后在所有其他时间点 ADA 检测呈阴性
在关键性研究 003 中,一名患者在第 6 个月时检测呈 ADA 阳性
在研究 004 中,两名患者 ADA 检测呈阳性,一名在第 29 天,另一名在第 3 个月
通过比较 ADA 阳性和 ADA 阴性患者血药浓度以及 24 小时尿草酸 BSA 校正值(ILLUMINATE-A)或尿草酸与肌酐比值(ILLUMINATE-B),抗 Lumasiran 抗体检测阳性的患者在 Lumasiran 的安全性、PK 或 PD 未观察到临床显著差异。接着对 ADA 阳性和阴性 PH1 患者尿液和血浆草酸水平以及健康受试者血浆乙醇酸水平,评估了 ADA 对中和活性的影响,因此没有建立中和抗体方法。上述结果表明,Lumasiran 具有较低的免疫原性,且不会对疗效和安全性产生影响[11]
Experience and Technical Capability in Immunogenicity Analysis of Oligonucleotides
鼎泰集团寡核苷酸药物
免疫原性分析经验和技术储备
随着越来越多采用新型结构修饰和作用机制的寡核苷酸药物研发的快速推进,免疫原性评估仍面临诸多挑战。一方面,我们需要进一步优化评估策略,综合考虑药物的化学结构特征、修饰类型、给药途径等因素,制定个性化的免疫原性评估方案;另一方面,应加强杂质成分对免疫原性潜在影响的研究,建立更加灵敏、特异的检测方法,确保药物质量和临床用药的安全性。此外,在产品研发的不同阶段,我们还应结合实际需求,制定高效、经济的方法开发和样品检测方案。
特别值得重视的是,不管是在非临床研究还是临床试验中,对于免疫原性的评价,不仅是分析方法精益求精的追求,更重要的是要着眼于免疫原性对产品有效性和安全性影响的评估;同时,这种以评估为导向的免疫原性研究恰恰构成了免疫原性风险评估和研究策略制定的基石。

作为深耕寡核苷酸药物研发服务的专业团队,鼎泰集团始终从监管要求出发、秉持科学原则、紧密跟踪客户需求和前沿技术发展。我们已在该领域积极开展储备资源和新技术方法的开发,并在多个项目中完成了方法学验证,为非临床研究提供了有力支持,极大缩短了研发投入周期。
截至目前,鼎泰集团已累计完成 60余款寡核苷酸药物的非临床药代动力学或毒理学相关研究,主导完成了 20 余个项目的免疫原性分析方法开发与验证工作,积累了丰富的实践经验。未来,我们将持续关注行业动态、不断突破技术瓶颈和提升服务质量,同时也期待与行业同仁深入探讨和交流,共同推动寡核苷酸药物研发领域的高质量发展。
供稿:生物分析中心Ⅰ部
参考资料:


































































































































