


上期文章,鼎泰团队对临床试验失败的6款siRNA药物及失败原因进行了复盘分析(点击查看原文),同时也借鉴这些案例启发我们如何在siRNA药物早期研究中更好地进行非临床药效学研究和概念验证试验。
siRNA药物通过调控mRNA增加或减少疾病相关蛋白的产生而发挥药理学活性。评价mRNA 和蛋白水平的变化,需建立合适的体外和体内模型。除了已被业界所熟知的基于LNP递送系统和GalNac偶联技术以外,对于肝外靶向递送、新型作用机制的siRNA药物,药效学研究或药代动力学/药效学(PK/PD)具有更为重要的意义。
与小分子药物和蛋白类药物不同, siRNA药物 PK/PD 关系独特:
血浆中暴露时间短、靶器官(如肝脏)中暴露时间长且药效作用持久
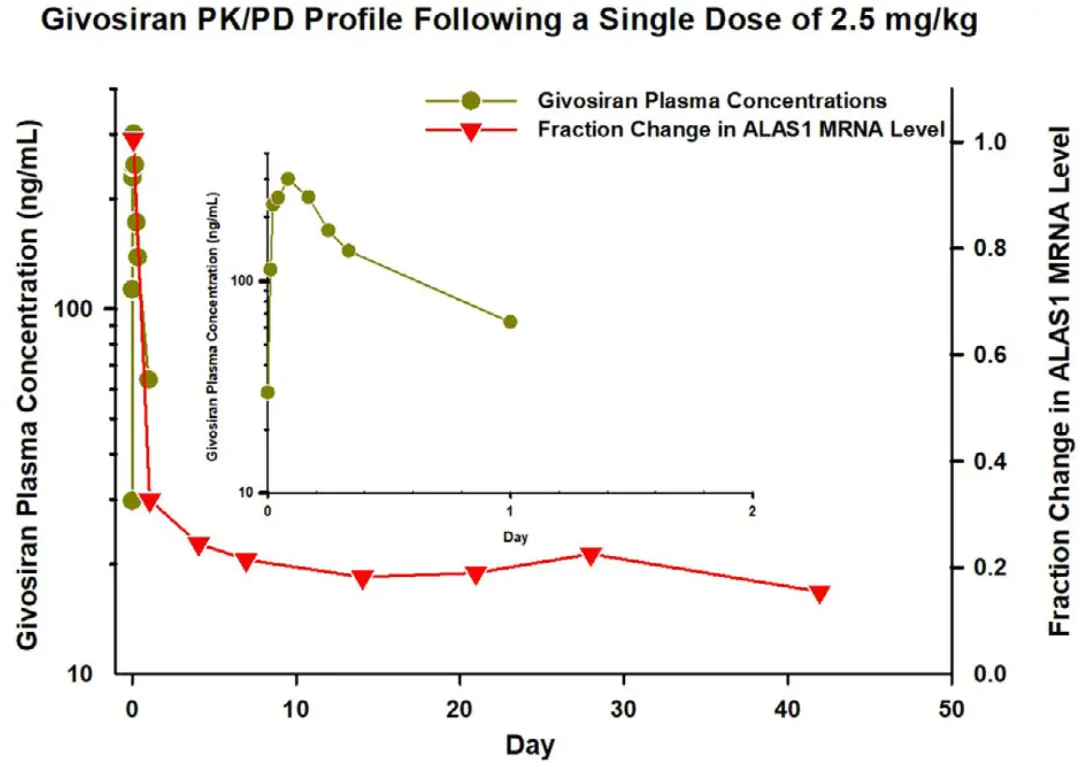
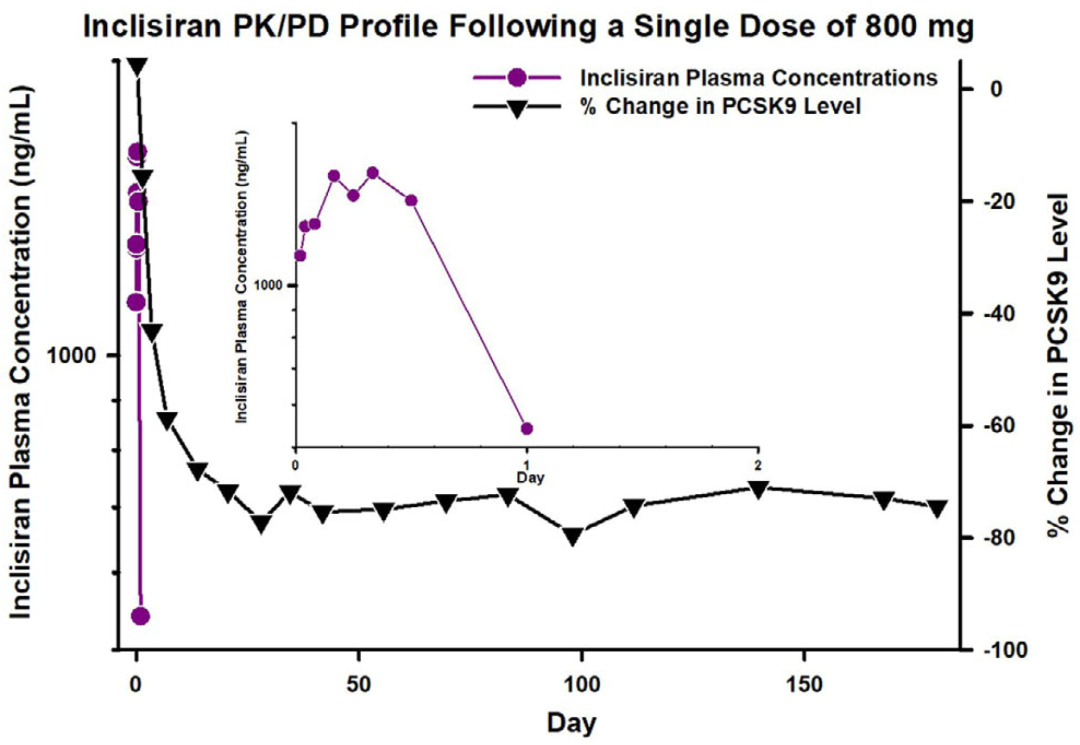
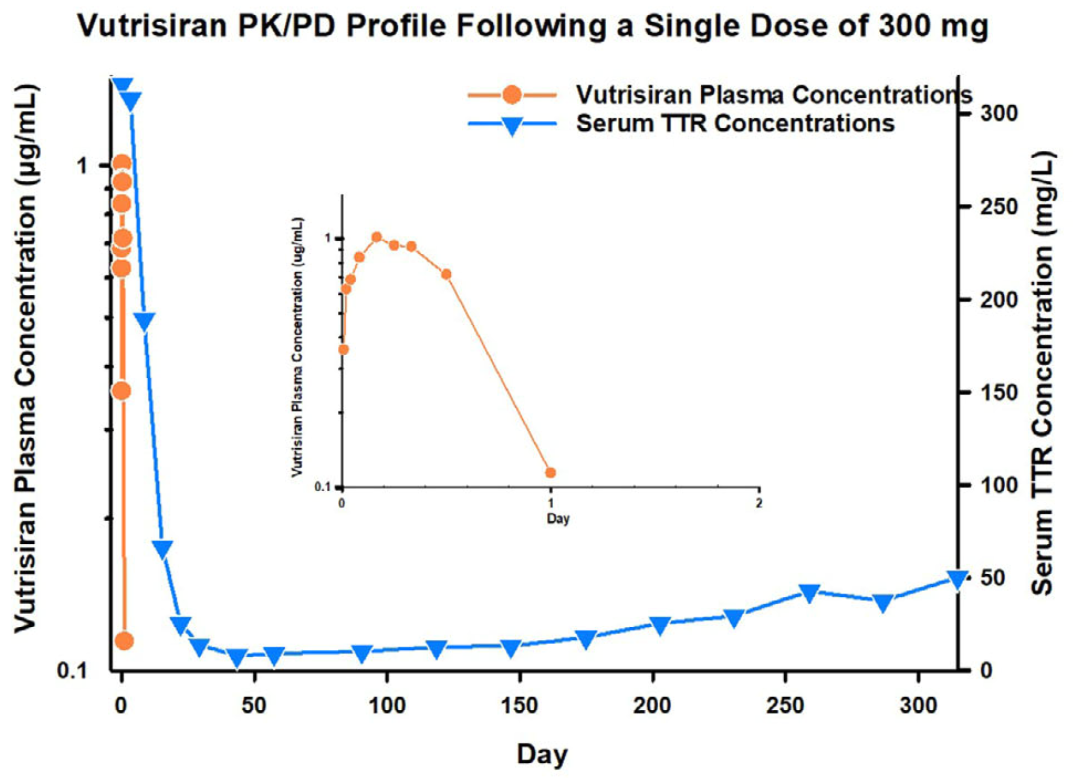
图1. Givosiran、Inclisiran 和 Vutrisiran:血浆中siRNA浓度和血清中PD标志物变化关系[1]
关键的药效学物质基础是胞浆中siRNA和RISC复合物,而非血浆或靶器官中总的siRNA浓度

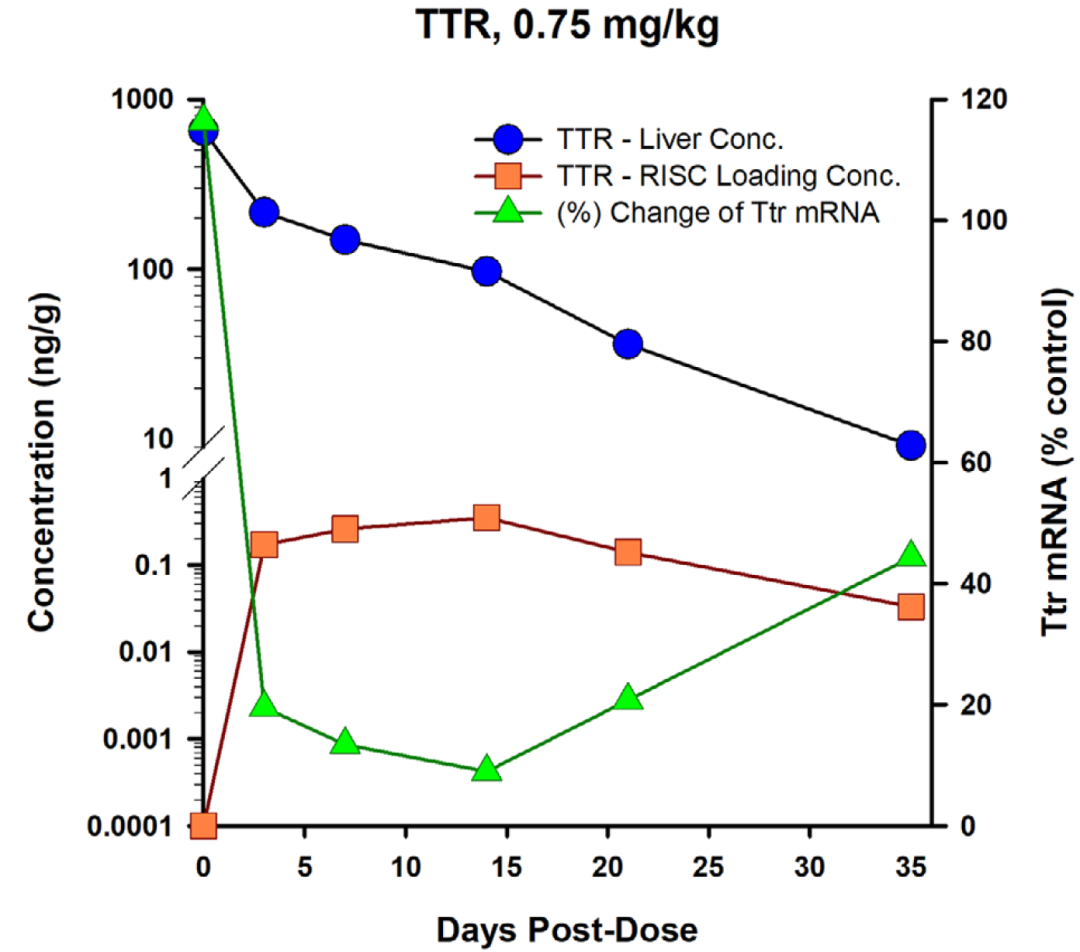
图2. 肝脏中siRNA总浓度、siRNA-RISC浓度和PD标志物变化关系[1]
siRNA的内体逃逸效率、siRNA与RISC的结合动力学也可能因平台或递送系统而异

图3. GalNac siRNA进入细胞、细胞内分布和发挥药理学活性的过程和关键步骤[2]
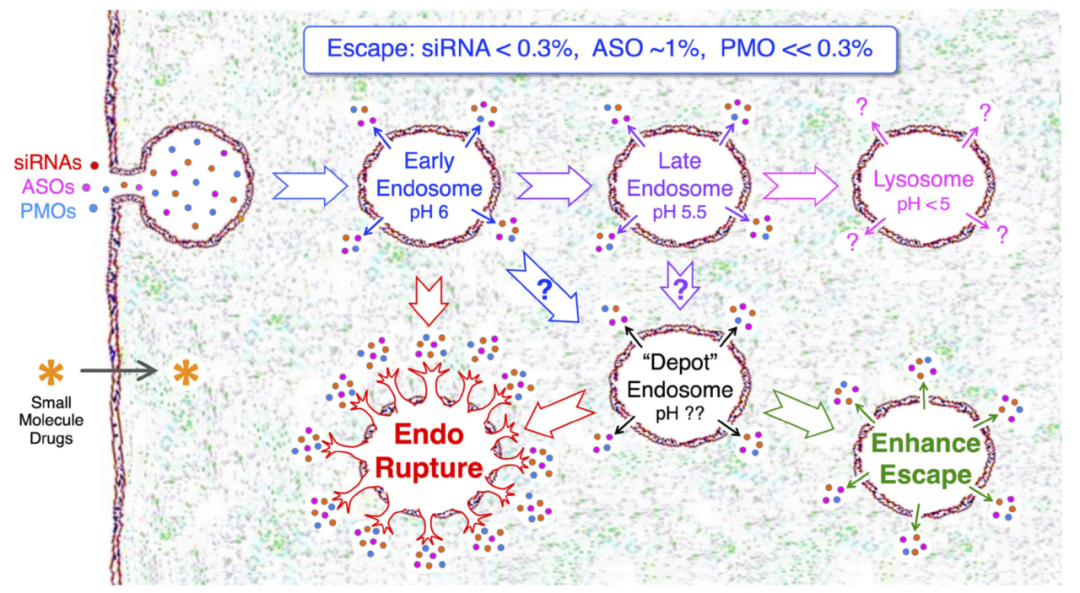
图4. 两种方案可提高 siRNA 内体逃逸效率[3]
上述特点使得siRNA药物的药效学评价和临床转化面临较大的挑战。未来需要开展更多关于siRNA药物作用机制和PK过程(包括细胞内PK)的定量研究,以获得更加精准的用于提示临床有效性和指导临床试验设计的非临床药效学数据。此外,整合已有的非临床和临床数据对模型进行改进和优化同样重要。
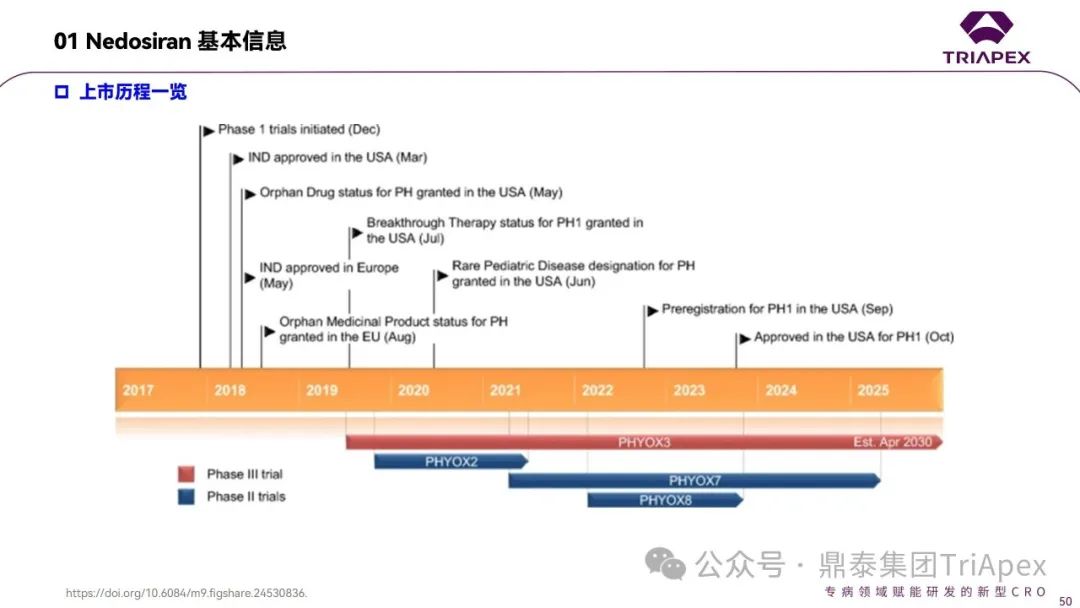
本文对已获得FDA批准上市的6款siRNA药物(截至2024年2月)的非临床药效学研究进行了汇总(文末查看),并简要总结了设计要点和研究思路。
体外活性和脱靶效应评价
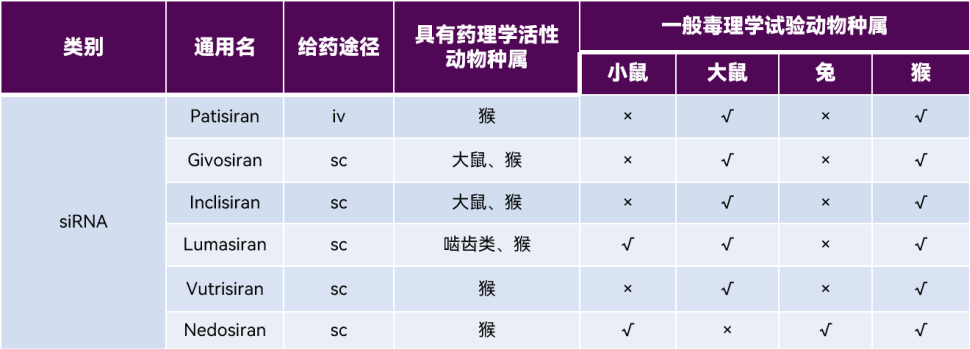
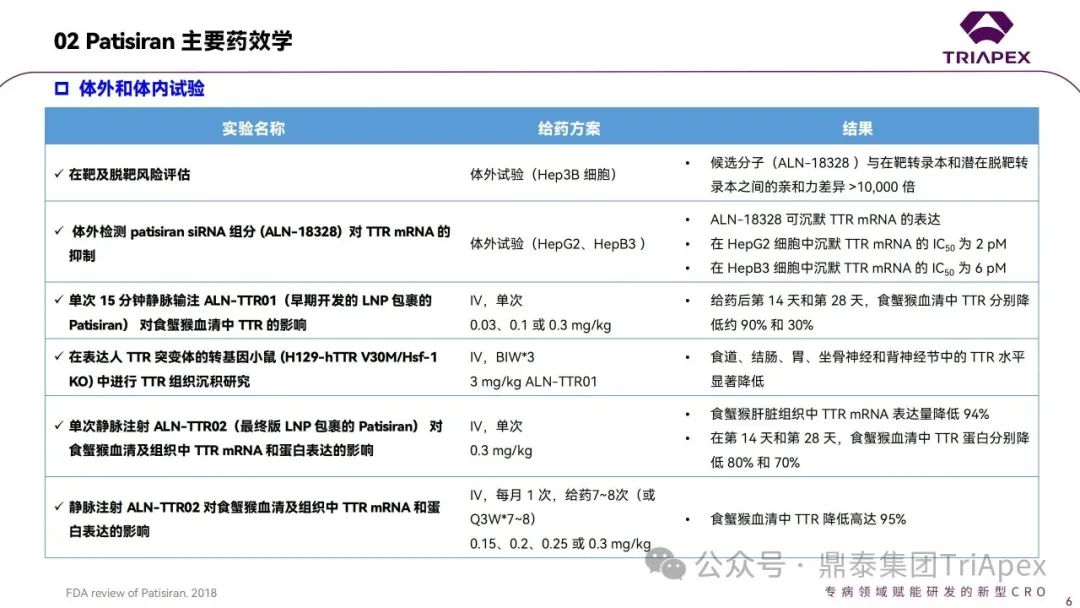
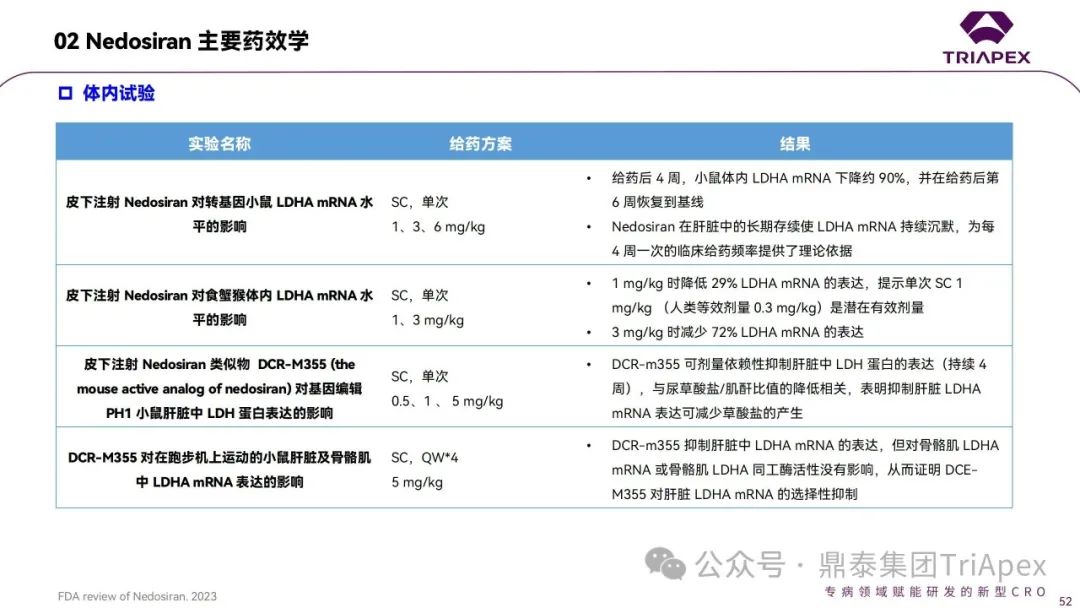
体外试验是siRNA药物研发的重要环节,用于筛选靶向特异性强、活性高的siRNA序列。通常,选择人或动物的原代细胞、细胞系或转染的细胞系作为试验体系,考察siRNA对细胞活性、功能、相关蛋白和靶mRNA 水平的影响。借助体外试验,除了可考察对人体靶点的作用外,还能评估对不同种属mRNA的影响,为毒理学试验中相关种属的选择提供依据。根据FDA审评报告,已上市的6款siRNA药物均可浓度依赖性地调控靶mRNA并改变蛋白表达水平,产生体外活性;均在猴体内表现出药理学活性。
表1. 已上市siRNA药物相关种属汇总
此外,借助在线工具(in silico)对不同种属间靶mRNA的同源性进行比对或预测其与候选siRNA药物的配对情况,为相关种属的选择提供参考;对人转录本中可能与候选siRNA药物发生杂交的非目标序列(脱靶序列)进行初步筛选,然后进行进一步的体外试验和/或更全面的风险评估(siRNA候选分子多层级脱靶效应评估策略,发表中)。
体内药效学
siRNA药物与靶mRNA 的配对具有很高的特异性,只有与靶mRNA同源性高的序列才能配对成功。通常,通过1中所述手段进行相关种属的选择,然后在相关种属动物中开展体内药效学研究;非人灵长类动物是评价siRNA药物体内药效学的重要模型,可以确定有效剂量范围并评估给药方案。如没有可产生药理学活性的相关种属,可选择转基因动物模型,或开展相应的体外药效学试验。
通过体内药效学试验,可对剂量-效应关系、时间-效应关系、疗效相关生物标志物等进行探索。此外,从定量药理的角度,PK/PD模型、剂量-效应-时间模型、PK/PB模型等在siRNA药物开发中发挥着重要作用,可用于将药物研发从临床前到临床各阶段的数据进行模拟、外推和预测。对于研发者充分理解和利用siRNA药物独特的PK/PD关系、指导siRNA药物的开发至关重要。科学合理地设计临床前药效学试验,结合转化角度的研究,可以更好地支持siRNA产品的临床试验设计和人体疗效预测,有助于确定临床首次人体试验(FIH)及不同临床阶段的给药方案,并用于NDA申请时作为支持临床剂量选择依据的描述。已上市siRNA药物,如patisiran和givosiran的上市批准均采用了上述药效学模型。
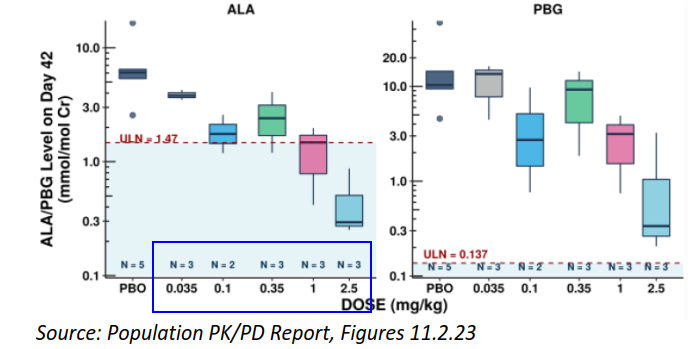
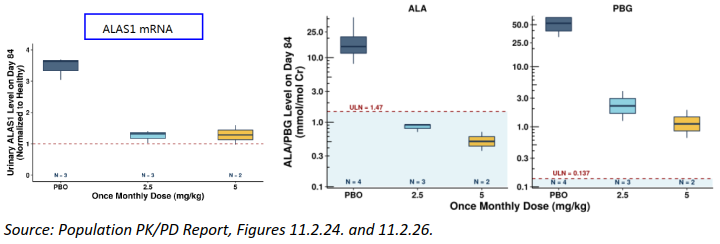
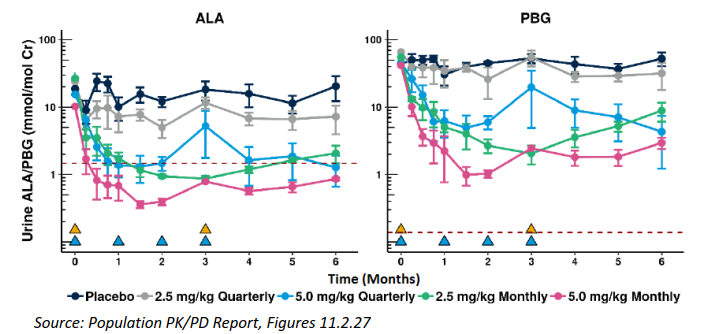
图5. Givosiran剂量-尿ALA/PBG水平(上)、剂量-尿ALAS1 mRNA/ALA/RBG水平(中)、剂量-尿ALA/PBG水平(下)相关性分析[4]
结语
在严格遵守动物实验伦理规范和不同国家药品监管要求的前提下,鼎泰集团依托丰富的非人灵长类动物疾病模型资源、专业的小核酸药物药效学、DMPK 和安全性评价经验,将持续高效助力国内外siRNA 药物的转化研究、临床开发和注册申报。
鼎泰集团子公司昆明科灵(KBI)在非人灵长类动物疾病模型药效学研究方面积累了丰富经验。依靠资源和技术优势,我们已经建立了多种自发性或诱导性非人灵长类动物疾病模型(恒河猴、食蟹猴,详见图6),这些模型具有与人同源性高、疾病的基因型和表型与疾病人群更为接近的优点。
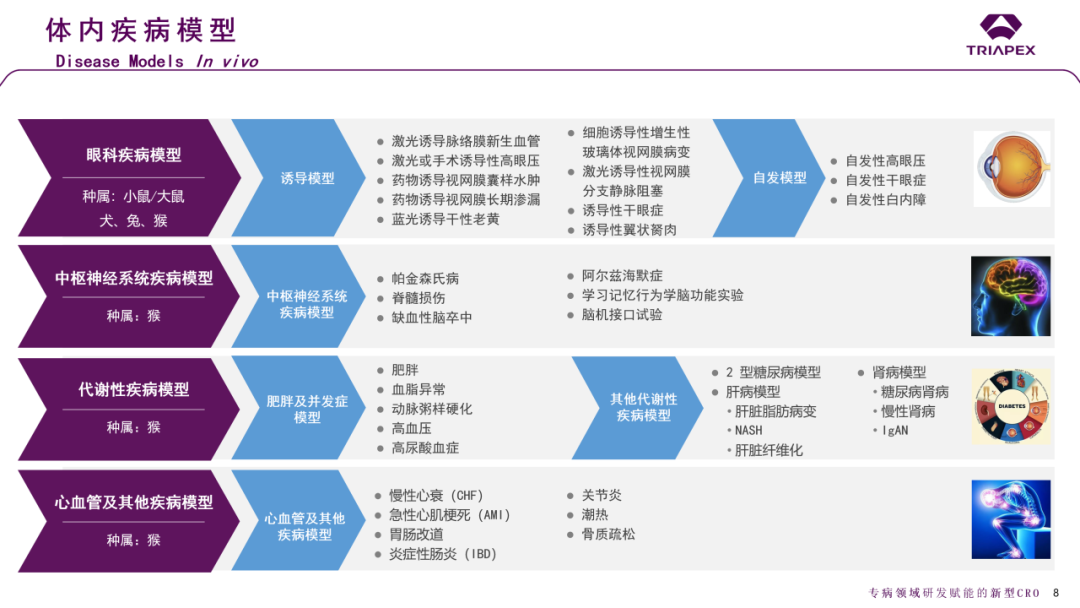
图6. 鼎泰集团已经建立多种适用于siRNA药物药效学研究的非人灵长类疾病动物模型
在siRNA领域,KBI常年与多家国内外领先核酸药物公司保持紧密合作。截至目前, KBI已完成了 30 多项siRNA药物的概念验证试验和临床前药效学研究,其中涵盖诸如高血脂、NASH、高血压等多个热门适应症。同时, KBI紧密跟进行业研发趋势和临床需求,借助鼎泰集团战略性优势,持续加强在新技术领域的前瞻性布局和技术能力建设,致力于满足不同客户在创新siRNA药物(包括新的适应症、递送系统、联合用药)研发需求的新模型的探索。


































参考资料:
[1] Guohua An. Pharmacokinetics and Pharmacodynamics of GalNAc-Conjugated siRNAs. The Journal of Clinical Pharmacology. 2024, 64(1) 45–57
[2] Jae Yoon Jeon, Vivaswath S. Ayyar. Amitava Mitra. Pharmacokinetic and Pharmacodynamic Modeling of siRNA Therapeutics – a Minireview. Pharmaceutical Research (2022) 39:1749–1759
[3] Steven F. Dowdy. Endosomal escape of RNA therapeutics: How do we solve this rate-limiting problem? RNA. 2023 Apr; 29(4): 396–401.
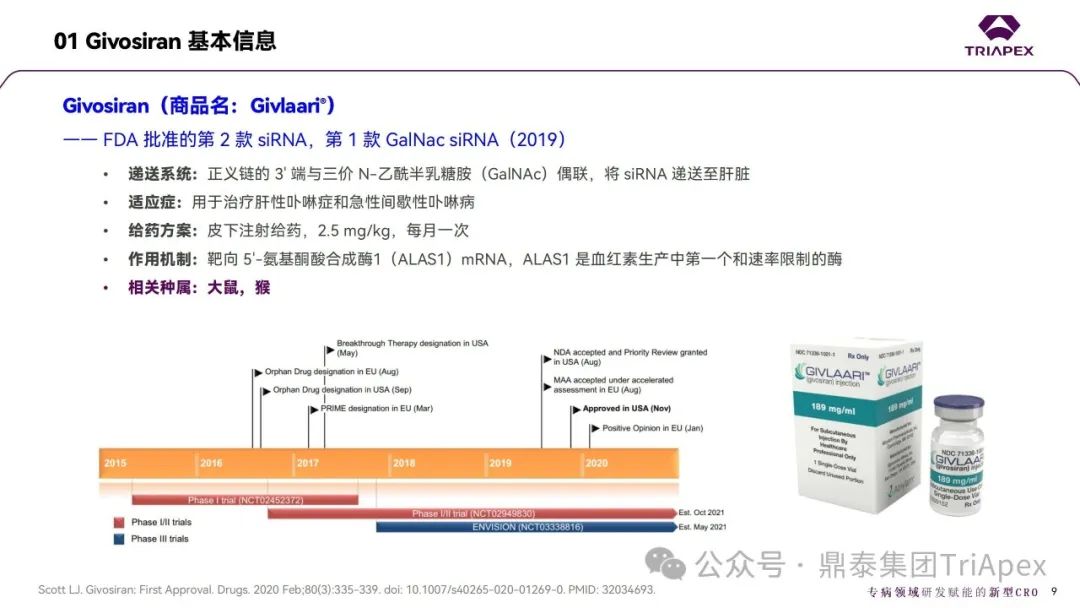
[4] MULTI-DISCIPLINE REVIEW of Givosiran.
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/212194Orig1s000MultidisciplineR.pdf
供稿:鼎泰集团转化科学和药政策略部
推荐阅读
2、首款siRNA药物在中国获批上市:PCSK9长效降脂药物的开发历程


































































































































