


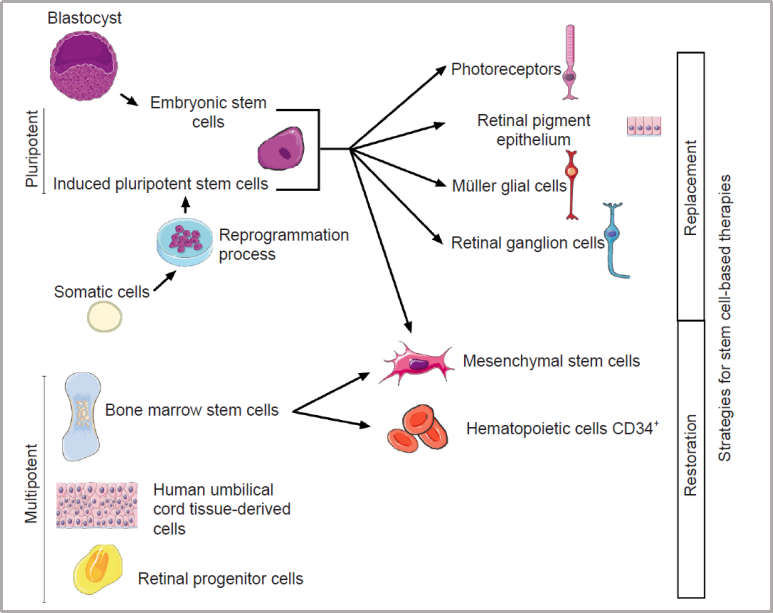
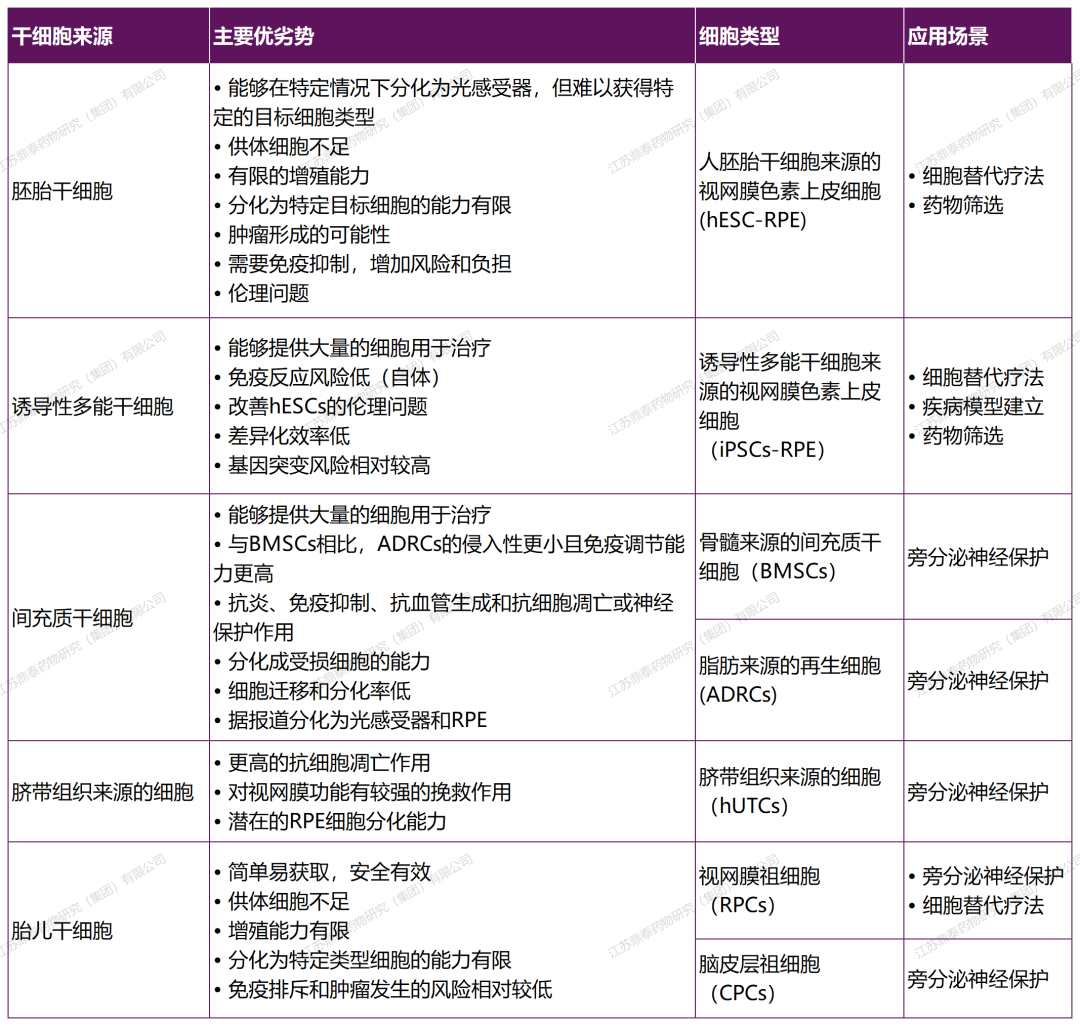
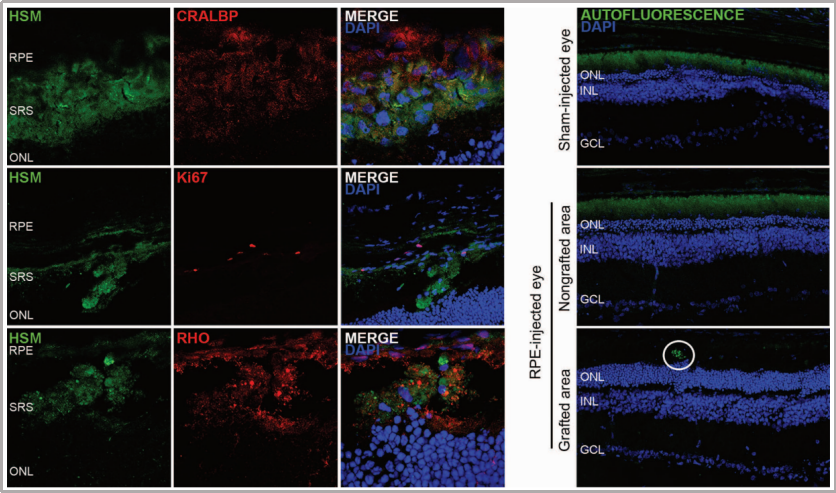
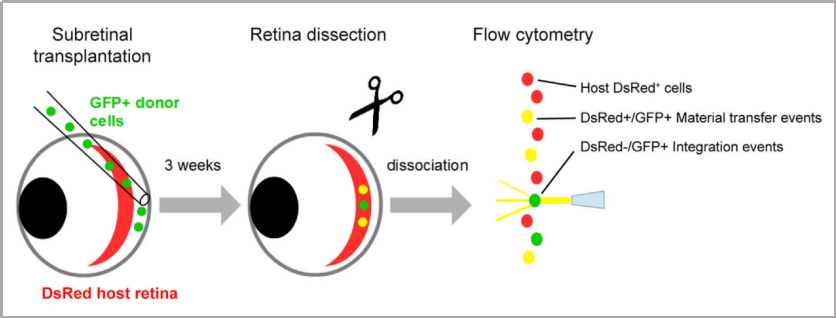
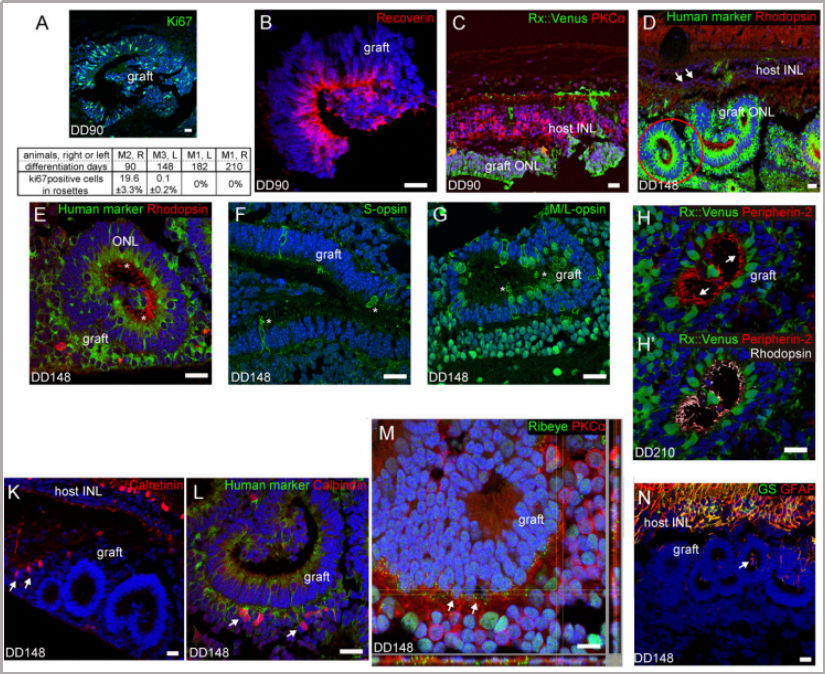
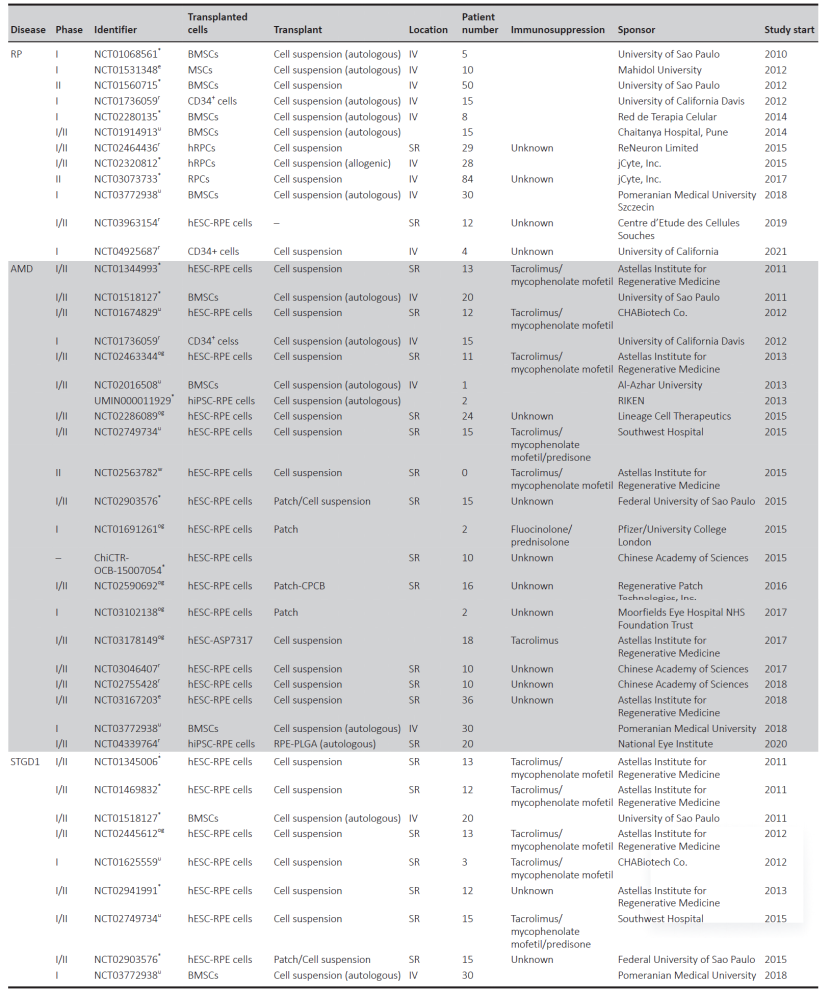
目录—— 1. 引言 2. 眼科干细胞治疗 3. 细胞来源 3.1. ESCs和iPSCs 3.2. MSCs 3.3. hUTCs 3.4. RPCs 4. 临床前研究 4.1. hESC/hiPSC来源细胞 4.2. hESC/hiPSC来源的视网膜细胞片移植 5. 临床研究 5.1. RPE细胞悬液还是RPE细胞片? 5.2. hESCs-RPE的临床试验 5.3. hiPSCs-RPE的临床试验 6. 总结 深度学术文章 全文共9927字 预计阅读时间25分钟 引言 视网膜是覆盖在眼球后方的多层平面组织。根据胚胎发育情况,视网膜可分为两层:由视网膜神经元和神经胶质细胞组成的神经视网膜层以及含黑色素的外层上皮细胞层——视网膜色素上皮细胞(RPEs)。 与RPEs相邻的是Bruch膜,能够让RPEs紧密连接在一起防止扩散,因此具有血液-视网膜屏障功能,也是形成眼部免疫豁免的物质基础。在靠近神经视网膜层的一侧,RPEs延长出顶突(类似细胞突触),伸入到光感受器外节段(POS)之间。RPEs的主要功能是吞噬和消除脱落的POS,维持光感受器的正常更新,以及促进视黄醛循环。 神经视网膜层由六种基本的视网膜神经元和胶质细胞组成。光线必须穿过整个视网膜,才能被最外层的两种光感受器(PRs)——视锥细胞和视杆细胞检测到。 光感受器的胞体位于外核层(ONL),其顶端突起,形成内、外节,位于不同的节层。PRs与位于内核层(INL)的神经元产生突触,形成外丛状层(OPL)。内核层的神经元包含双极细胞(Bipolar cells)、水平细胞(Horizontal cells)和无突细胞(Amacrine cells),负责光诱导刺激的初始处理。最后,双极细胞将处理后的信息传递给视网膜神经节细胞(RGCs),两者之间的突触形成内丛状层(IPL),而RGCs胞核则形成一个独特的神经节层(GCL)。RGCs轴突位于视网膜的最内层,浓缩成视神经,最终投射到大脑的视觉皮层。 图1. 视网膜结构 视网膜退行性疾病被认为是导致失明的主要原因,主要包括年龄相关性黄斑病变(AMD)、视网膜色素变性(RP)、Stargardt病等。此类疾病可以导致视力持续丧失、视野缺损甚至致盲。在AMD患者中,传统抗VEGF治疗仅能靶向渗出性AMD的脉络膜新生血管,但对于萎缩性AMD的地图样萎缩尚无有效办法。 近年来,部分基因治疗产品表现出对视网膜萎缩性疾病治疗的良好结果,大量基于细胞的治疗手段也被开发应用于替代萎缩/凋亡的视网膜细胞从而重塑视觉功能。哺乳动物的视网膜细胞几乎没有再生能力,因此可以增殖和分化的干细胞产品将会是治疗视网膜下退行性疾病的新选择。 眼科干细胞治疗 干细胞产品用于治疗视网膜变性疾病有两个基本策略: 一是采用干细胞分化而来的视网膜细胞替代功能异常的细胞从而恢复视网膜功能。此策略通常采用人源胚胎干细胞(hESCs)/人源诱导多能干细胞(hiPSCs)来源的光感受器(PRs)、视网膜色素上皮细胞(RPEs)、Müller细胞和视网膜神经节细胞(RGCs)。 二是利用干细胞释放的神经营养因子,消除或挽救导致视网膜萎缩的因素。此策略通常采用骨髓间充质干细胞(BMSCs)、人类脐带组织来源细胞(hUTCs)和视网膜祖细胞(RPCs)。 移植的细胞需要整合进视网膜组织长期存在并且形成新的突触连接。此外,移植细胞产生的神经营养因子能够起到保护视网膜的作用。 图2.干细胞治疗视网膜疾病的两种策略 细胞来源 01 ESCs和iPSCs 胚胎干细胞(ESCs)是来源于囊胚内细胞群的多分化潜能细胞。在多种疾病领域,应用ESCs进行细胞治疗已经开展了大量的临床及临床前研究。然而,hESCs治疗的一个主要问题是移植的外源细胞会被宿主免疫系统排斥,避免排斥的一种替代方法是使用诱导多能干细胞(iPSCs)。 iPSCs是通过不同的方法对体细胞(如成纤维细胞、血细胞和尿液细胞)进行重编程而获得的。与ESCs相似,iPSCs可以诱导分化成机体所有细胞。由于iPSCs来自于体细胞,因此不存在ESCs的伦理问题。除了来源于患者自身的体细胞,iPSCs也可以根据人类白细胞抗原(HLA)类型进行患者和供体匹配,一定程度上实现了通用型细胞治疗方法。 iPSCs用于细胞治疗的难点之一就是其重编程过程。最早的重编程方法是使用逆转录病毒载体将四种转录因子(c-Myc、Oct4、Sox2和Klf4)导入体细胞,因此可能存在遗传毒性风险。c-Myc作为一种原癌基因,有诱导细胞向肿瘤分化的风险,很多研究也已经使用了非整合或不含c-Myc的诱导方法。 利用iPSCs进行细胞治疗也存在一些其他问题,如表观遗传记忆。有研究表明,hiPSC-RPEs保留了起源体细胞的基因表达 ”记忆“ ,可能影响某些细胞特性,如增殖和衰老。此外,由于它们较强的增殖分化能力,已经被发现了许多严重的安全性问题。有报道指出,未经分化或分化不完全的细胞在移植后可以产生畸胎瘤,并诱导潜在的免疫反应。 因此,在iPSCs来源的细胞应用于临床之前,必须制定稳健的分化方案,最大限度地降低细胞异常增殖的风险。 02 MSCs 间充质干细胞(MSCs)主要来源于两个成熟的器官/组织,骨髓和脂肪。骨髓中除了造血干细胞(即CD34+细胞),还存在一类非造血干细胞——骨髓间充质干细胞(BMSCs)。 BMSCs能够向病变部位迁移,且具有横向分化能力,即在特定环境下分化为其他器官的细胞。RPE细胞受损时会表达特定的趋化因子,诱导BMSCs向受损部位迁移。BMSCs通过产生神经营养因子,发挥抗炎作用,促进细胞存活。 脂肪间充质干细胞 (ADSCs)又被成为脂肪来源的再生细胞(ADRCs),是一种非常有前景的干细胞来源,已经在心脏等各种器官中开展了相关研究。与 BMSCs相比,ADSCs更容易从活体捐赠者身上获取,侵入性较低。此外,它们增殖更快,并表现出更高的免疫调节能力。 MSCs已被证明具有抗炎、免疫抑制、血管生成和抗细胞凋亡或神经保护作用。MSCs在治疗视网膜疾病中主要是发挥其分泌神经营养因子或抗炎调节剂的作用,促进细胞存活。此外,MSCs一样具有多能分化潜能。有报道指出,BMSCs到达损伤部位后可以分化为视网膜细胞,如光感受器和RPEs,修复受损组织。然而,目前尚不清楚上述分化形成的细胞是否能代表 MSCs 与宿主原本的光感受器融合。 03 hUTCs 人脐带组织来源的细胞(hUTCs)可分泌生长因子(肝细胞生长因子、胶质细胞源性神经营养因子等)、多受体酪氨酸激酶配体、桥接分子、细胞因子等。hUTCs还可分泌参与突触连接和神经元生长的血小板反应蛋白。 04 RPCs 视网膜祖细胞(RPCs)是胚胎发育过程中视网膜形成的起源细胞,是视网膜疾病治疗中一个非常重要的细胞来源。RPCs可以从妊娠16至20周的胎儿视网膜中获得。它们能够沿着光感受器谱系迁移和分化,并可能在退行性视网膜疾病中取代视杆细胞和视锥细胞。RPCs移植既能通过分泌增强视网膜存活的营养因子促进神经保护,也能直接进行光感受器替代。 表1.细胞来源及其在视网膜疾病中的应用 由于目前眼科干细胞治疗的临床试验大部分都以hESC/hiPSC来源的细胞进行移植治疗视网膜疾病,本文重点对这一类型的产品作简要介绍。 临床前研究 01 hESC/hiPSC来源细胞 自2004年,多项研究报道哺乳动物视网膜移植hESC/hiPSC来源的视网膜细胞可以使视网膜细胞具备再生潜能和重新获得视觉功能。在视紫红质敲除的小鼠(rho-/-)中,胚胎视网膜前体细胞眼内移植后可以分化为视网膜系细胞。许多研究表明小鼠ESC/iPSC 来源的细胞移植后可以恢复视网膜变性的大鼠/小鼠视觉功能。hESCs-RPE在大鼠/小鼠模型中移植后可以恢复光感受器、改善视觉功能,并且展现出良好的长期安全性。 RCS大鼠是一种遗传性视网膜变性(Mertk突变)的动物模型,其RPEs存在吞噬功能缺陷,已广泛应用于细胞移植的临床前研究。该模型中,hESC/hiPSC-RPE移植后能够形成RPE层整合进宿主的视网膜,并建立紧密连接,发挥吞噬光感受器外段(POS)的作用,并在移植后12周内改善了宿主视网膜功能。另外,hESC/hiPSC-RPE细胞也有神经保护作用,保护视网膜免受细胞变性和神经胶质应激的影响。 图3.RCS大鼠模型,自身荧光(AF)作为吞噬标记物。(Riera et al., 2016) 视网膜色素变性(RP)是一种光感受器和RPEs退行性变的视网膜疾病,细胞治疗的策略通常是在疾病的早期或中期替换功能失调或死亡的视锥细胞和视杆细胞。移植物为前体细胞,需包含极化的外核层(ONL)以及光敏的外节段(POS),细胞轴突延伸到外丛状层(OPL)并与中间神经元(双极细胞)的树突形成突触连接,将信号传递到视觉通路。 hESC/hiPSC来源的PRs前体移植动物模型视网膜后可以观察到可靠的组织整合并表达光感受器的特异性标志物。自从2011年起,大量的研究探索了如何从3D拟胚体中获得不同发育阶段的光感受器。有研究表明,hESC/hiPSC来源的光感受器前体细胞移植能够恢复视觉功能,这可能与移植细胞与宿主细胞间的物质交换有关。这种蛋白质交换以胞质融合为基础,并且仅限于PRs和移植PRs的内源性交互作用,从而恢复了功能异常的光感受器。基于以上原因,前体细胞移植成功与否有赖于宿主本身具有一定功能的光感受器存在,因此对于宿主视网膜状态有一定要求。 图4.细胞间物质交换研究策略。(Waldron et al., 2018) 02 hESC/hiPSC来源的视网膜细胞片移植 与视网膜中的其他细胞不同,RPEs不需要突触连接,呈单层排列,其发挥功能需要细胞之间的紧密连接,并通过Bruch膜维持离子运输能力。Bruch膜是由视网膜色素上皮基底膜和脉络膜毛细血管基底膜间的胶原纤维所构成的结构,可调节两者间的代谢,维持正常视觉活动。 hESC-RPE细胞片则是将单层极化的RPE细胞种植在聚对二甲苯膜上。聚对二甲苯膜是一种人造的Bruch膜,能够让RPE细胞产生粘附。这种基质不可降解,具有渗透性,能够在视网膜下腔移植后稳定存在。有研究人员评价了hESC-RPE细胞悬液和细胞片在大鼠移植后的细胞存活和成瘤情况。结果表明未观察到畸胎瘤或异位组织产生,且hESC-RPE细胞片比细胞悬液具有更好的生存率。另一项研究中表明hiPSC-RPE细胞片在大鼠移植后可以安全稳定存活并且产生功能。这些研究都证明了细胞片移植的可行性,并且与细胞悬液相比,细胞片的系统性分布更低。 3D培养技术的发展已经足以获得任何分化阶段的能够自我组装的多层视网膜组织,并用于移植。目前,人们已建立了多种可获得大量用于移植的hESCs/ hiPSC-PRs的 3D培养方案。 有研究评价了小鼠ESC/iPSC来源的3D视网膜组织用于晚期视网膜变性小鼠(rd1)模型移植,结果发现宿主眼球内生成了可再生的视泡以及视网膜神经上皮样层结构,即使在缺乏ONL的模型(rd1)中也发展出具有完整内外段的结构化ONL,表明在小鼠视网膜下腔移植可形成发育良好的分层视网膜结构。此外,小鼠移植ESC-iPSC来源的视网膜片可以形成完整的外核层以及具有光反应的成熟光感受器。 灵长类动物研究发现hESCs来源的视网膜片在猴视网膜移植后能够存活、整合并发育出结构化的光感受器。另一项研究中,研究人员在一只猴中发现hiPSCs 来源的视网膜片移植后可以长期存活。 图5.hESC-视网膜片移植的非人灵长类模型。(Shirai et al., 2016) 临床研究 2010年,美国ACT公司(Advanced Cell Technology)最早获得FDA批准开展细胞治疗眼科疾病I/II期临床试验,其采用hESC-RPE治疗两种退行性视网膜疾病:干性年龄相关性黄斑变性(AMD)和Stargardt病。前期临床前模型中已证明利用干细胞治疗手段可以挽救视网膜色素变性和预防视力丧失。 01 RPE细胞悬液还是RPE细胞片? 迄今为止,临床试验的研究主要集中在移植hESC/hiPSC来源的RPEs来预防或减缓视网膜变性。有研究在临床上评估了两种不同的移植物,即RPE细胞悬液和RPE细胞片。RPE细胞悬液移植临床试验中目前未观察到任何严重的不良反应,但仍然不清楚该情况下细胞能否在体内形成单层组织。从长期疗效的角度,移植的RPEs必须极化整合进宿主视网膜,并与邻近的RPEs建立联系,才能发挥其吞噬和物质运输功能。然而,视网膜下腔注射可能会因为注射形成的视网膜裂孔而导致供体RPEs损失。 因此,RPE细胞片移植可能是更理想的治疗手段。在RPE细胞片中,细胞完全分化,细胞之间直接形成连接,其结构接近原生细胞。此外,细胞片的递送可以降低增生性玻璃体视网膜病变(细胞在玻璃体腔内迁移和增殖导致视网膜脱离)的风险,这也是细胞治疗中最严重的临床并发症。然而,与视网膜下腔注射RPE细胞悬液相比,RPE细胞片也可能增加视网膜脱离的风险。 为了临床应用,Kamao等人开发了一种方案,用于从hiPSC-RPE细胞中获得RPE单层膜,不使用任何合成支架,而是自行生成由IV型胶原和层粘连蛋白组成的基膜。在脉络膜新生血管移除后的新发AMD中,这种技术被证明是有效的,没有排斥迹象,患者也无需额外的抗VEGF治疗。这种治疗手段的主要问题是较高的费用以及漫长的准备时间(超过 10 个月)。 另有研究表明,移植无支架的RPE细胞片导致RPEs在萎缩区域聚集而无法均匀分布,有支持性支架的RPEs在宿主视网膜中表现出更好的整合。Bruch膜是RPE细胞的一层基底膜,会随着年龄的增长而改变,并且会影响RPEs的代谢和附着。有研究团队把合成的超薄聚对二甲苯作为基质层模拟Bruch膜的特性,或者使用人类玻璃体结合蛋白修饰的聚酯纤维膜,将RPEs粘附在这些材料上进行移植。 02 hESCs-RPE的临床试验 首例使用hESCs-RPE治疗的临床试验结果于2012年发表,入组病人包含13名干性AMD患者和13名STGD1患者。细胞治疗的前3个月需要进行全身性免疫抑制以减少免疫排斥。28%的患者都发生了免疫抑制导致的不良反应。全身免疫抑制剂的使用也可能导致尿路感染、胃肠道症状或非黑色素瘤皮肤癌等并发症。在该项临床试验中,经过4个月的随访,没有观察到过度增殖的迹象。 来自安斯泰来再生医学研究所的一项研究招募了18名晚期干性ADM或STGD1病患者。研究进行了12至36个月的随访,72%的患者仍可在一年后观察到移植的细胞。这18名患者中,有10名患者的最佳矫正视力有所提高,1名患者患有葡萄球菌眼内炎和白内障进展。未接受治疗的对侧眼则未见改善。但考虑到缺乏对照组来控制安慰剂效应和视力测量的主观性、样本量有限、初始视力较差等因素,上述研究结果可靠性仍然存在担忧。 在另一项研究中,4例患者(2例干性AMD和2例STGD1)hESC-RPE移植后进行了1年的随访,未观察到不良增殖或致瘤性,3例患者视力改善,1例未见改变。 我国重庆第三军医大学西南医院阴正勤团队对7例STGD1患者在治疗后进行了5年随访,证实了hESC-RPE细胞移植的长期安全性和耐受性。 自hESC-RPE细胞移植的首次报道以来,许多更复杂的重建组织方案被提出,如利用再生医学的3D生物工程组织替换受损的细胞或组织;开发RPE薄片或基质材料,使细胞对手术过程更耐受,与悬浮细胞相比提高存活率,增加细胞形成定向组织的几率。 Kashani等人设计了一种使用支架的植入物,称为加州治愈失明项目——视网膜色素上皮 1(CPCB-RPE1), 它由 hESC-RPE 细胞的极化单层组成,附着于超薄合成聚对二甲苯基材上,旨在模拟Bruch膜。参加该研究的五名患者中有四人成功接受了CPCB-RPE1移植。在所有植入的受试者中,OCT显示hESC-RPE和宿主光感受器出现整合。所有移植眼均未出现进展性视力丧失,一名患者的视力还得到改善,另外两名患者的固视能力得到改善。hESC-RPE细胞也可以附着在人体玻璃体连接蛋白涂覆的聚酯纤维膜上,然后移植到视网膜下腔。在第一项相关研究中,研究人员对两例严重湿性AMD患者随访12个月后,证明了RPE细胞片的有效性和安全性。 03 hiPSCs-RPE的临床试验 2013年,日本理化学研究所(RIKEN)开展了首例使用自体hiPSC治疗AMD的临床试验。该患者未进行免疫抑制。术后1年,移植片保持完整,最佳矫正视力没有改善或恶化,但观察到黄斑囊样水肿,未观察到肿瘤形成。第二例患者在其自体hiPSC中观察到三个单核苷酸变异和拷贝数改变,因此未进行治疗。但研究者认为这些信息不足以评估其致瘤性,且并尚未有RPEs发生转移性肿瘤的报道。 在2017年开展的另一项自体hiPSC治疗湿性AMD患者的试验中,随访25个月无不良事件发生,但视力没有改善。这项试验也有在iPSCs阶段发现突变的情况,相应的患者未进行治疗。 自体iPSC来源的细胞移植可以避免免疫排斥问题,但由于成本和所需的时间,尚未成为一种标准治疗方法。 RIKEN又在2017年为5名患者移植了HLA匹配的异体hiPSC-RPE细胞。随访1年后未见细胞异常增殖,但出现角膜糜烂(1/5)、视网膜前膜(1/5)、眼内压升高(3/5)、眼内炎(1/5)、眼内轻度免疫排斥反应(1/5)等不良事件。尽管如此,上述研究也是第一项证明同种异体hiPSC-RPE细胞移植的安全性和存活率的研究。 2020年,美国国家眼科研究所启动了一项新的临床试验,对20名AMD患者进行了治疗,以评估聚乳酸-乙醇酸支架的hiPSC-RPE细胞片移植的安全性。聚乳酸-乙醇酸是一种具有生物相容性和可生物降解的RPEs移植支架,已被证明可形成类似Bruch膜的结构。 表2. 干细胞产品治疗视网膜疾病临床研究汇总 总结 利用干细胞产品移植治疗视网膜疾病已经取得了很大的进展,临床前和临床研究在一定程度上证明了其安全性。目前还需要更多的研究对此类产品的有效性进行改善。由于RPE移植后需要形成有紧密连接的细胞层才能维持视网膜形态和血-视网膜屏障完整,因此移植RPE细胞片可能优于移植细胞悬液。在大部分视网膜退行性疾病中,患者视网膜多种细胞均受累,因此同时移植RPE和或其他视网膜细胞(如光感受器)可能让患者的视觉功能更大获益。开发复杂的多层视网膜细胞甚至视网膜类器官移植将是这一领域的趋势。此外,移植的手术流程以及术后干预方案也需要在未来被进一步优化。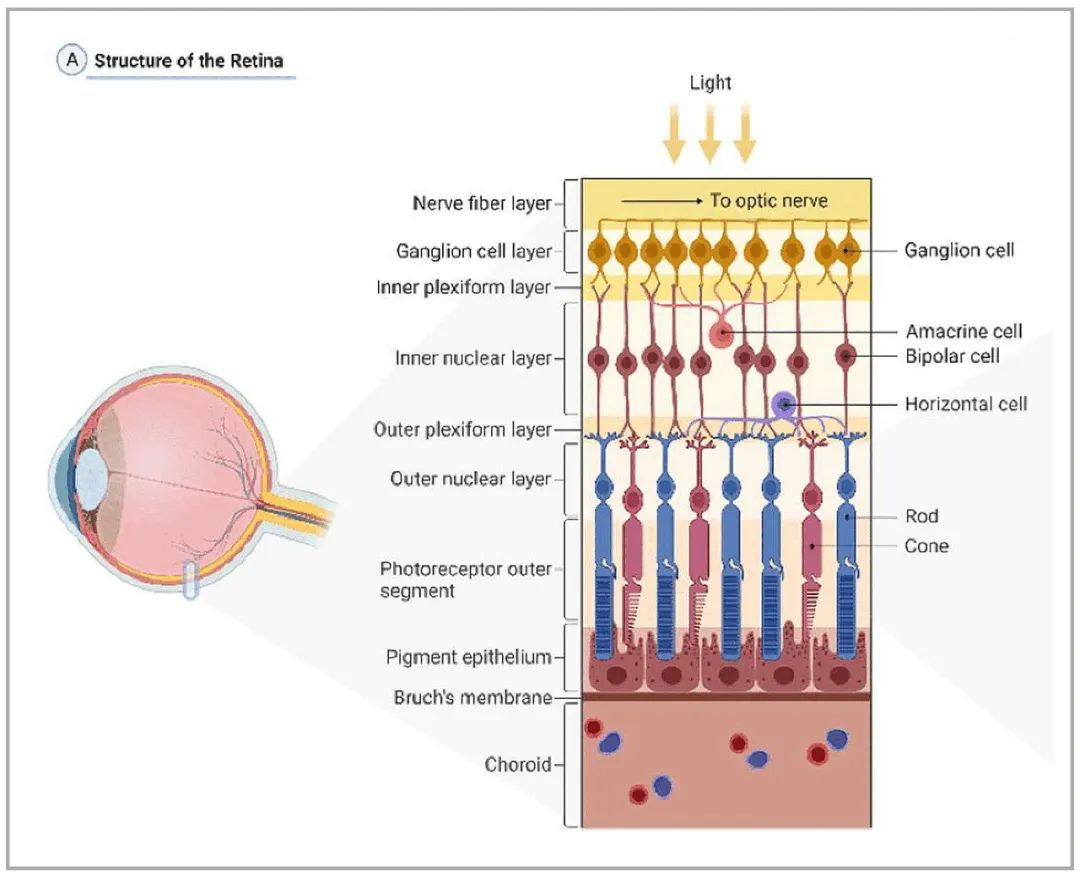
参考资料: 免责声明:本文来自鼎泰集团内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,如需转载请添加微信LXL--7。本文仅作信息交流而非商业盈利之目的,内容仅供分享学习。


































































































































