


作为新型治疗药物,寡核苷酸药物具有独特 PK 特征,这是决定其药理活性和毒理学属性的物质基础。本文对这些特征进行系统汇总,并提出了 ADME 研究的思路。
全文共:5643 字 10 图
预计阅读时长:15 分钟
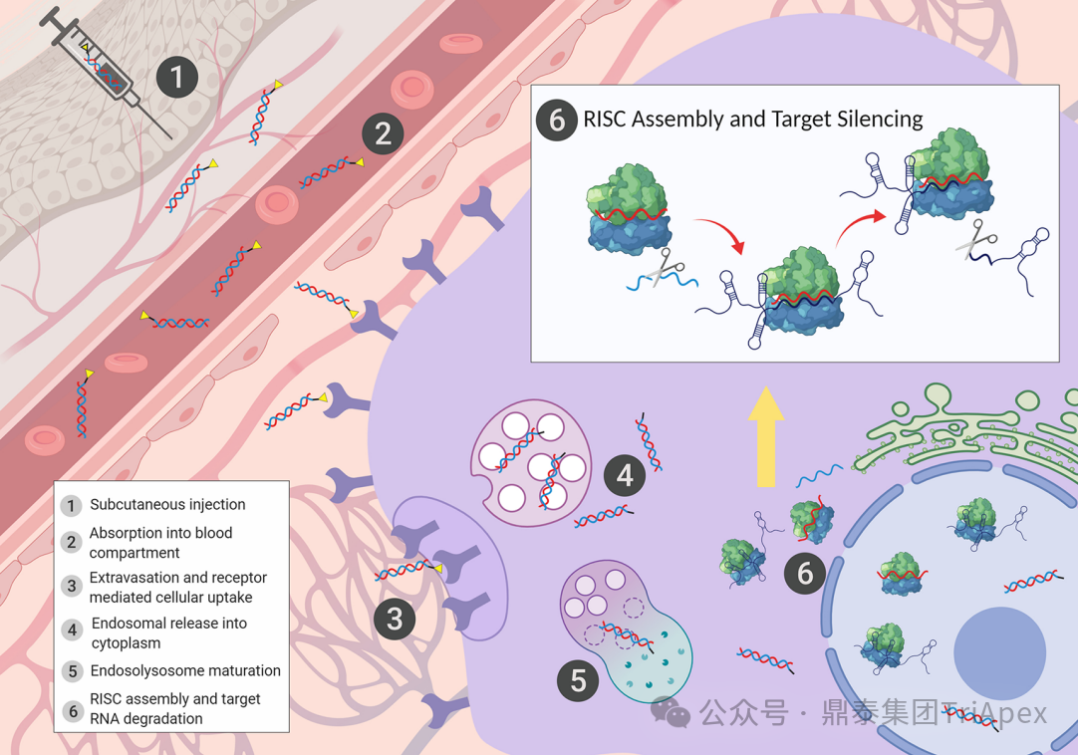
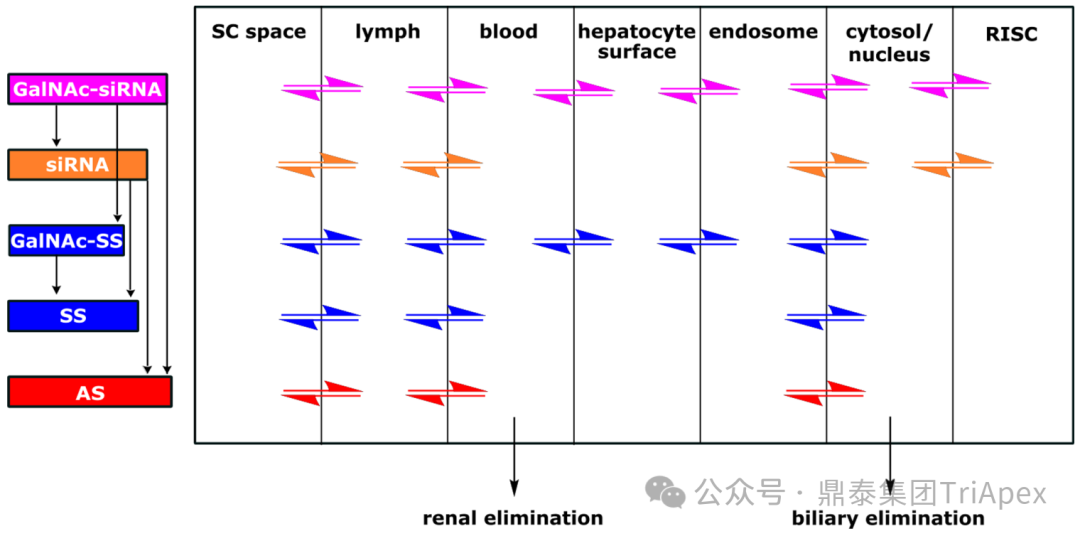
图1. GalNAc- siRNA 在机体内的 ADME 过程[1,2]
业界已在寡核苷酸药物的关键要素 —— 序列设计、化学修饰和递送系统等方面积累了丰富的经验。然而,对于非临床药代动力学(PK)研究尚缺乏系统的认识。尽管 OSWG 白皮书中已提供了相关研究思路和建议,但迄今尚无针对寡核苷酸药物 PK 研究的官方监管指南。目前,针对寡核苷酸药物的 PK 研究,通常遵循 ICH M3(R2)和 ICH S6(R1)中推荐的研究策略和方法,但由于寡核苷酸类药物具有独特的理化性质和作用机制,需根据其特点进行调整与优化研究策略。
在非临床 ADME(吸收、分布、代谢、排泄及其相互作用)研究中,精准评估寡核苷酸的 PK 特征尤为重要。通过设计精准、结果可靠的 PK 研究,可以更深入地理解寡核苷酸药物的安全性和有效性,为临床剂量的推导和给药方案的设计提供科学依据。如何开展符合科学性和适用性的 PK 研究,是一个凝聚多方智慧和研究策略的过程。本文基于既往经验和对已批准寡核苷酸药物 PK 数据的整合分析,提出了系统的非临床 ADME 评估思路和策略,以期与相关领域的研究者进行交流。

寡核苷酸药物药代动力学特征和研究方法
寡核苷酸药物极性大、水溶性高,不能穿过细胞膜,难以分布至靶器官,易被核酸酶降解,需化学修饰(如硫代磷酸酯)或递送系统(如 LNP 脂质纳米颗粒、GalNAc 偶联)提高稳定性及改善 PK 特征。总体而言,寡核苷酸药物呈现出与传统小分子或抗体药物不同的 PK 特性(图2)。

图2.不同类型化合物药代动力学性质汇总对比
一、吸收
寡核苷酸药物通常采用的给药途径包括:静脉注射(IV)或皮下(SC)注射等胃肠外途径全身给药,或鞘内(IT)或侧脑室(ICV)注射、玻璃体内(IVT)注射等局部途径给药。
LNPs 包裹的寡核苷酸药物一般采用 IV 给药,给药后从 LNP 中释放,快速进入血液循环。在一定剂量范围内,稳态暴露水平(Cmax 和 AUC)与给药剂量正相关。GalNAc 修饰的寡核苷酸药物通常采用 SC 给药,给药后迅速吸收入血并快速达峰。由于 ASGPR 介导快速分布进入肝脏,寡核苷酸药物从血浆中快速清除,血浆暴露有限。在一定剂量范围内,系统暴露水平(Cmax 和 AUC)随剂量增加而增加;超过一定剂量后,ASGPR 介导摄取暂时饱和,摄取至肝细胞中药物减少、血浆暴露增加,暴露水平可能会高于剂量增加比例。
一般来说,非临床 PK 评价中应使用预期的临床给药途径。当临床途径不是 IV(如 SC、IT 或 IVT 给药)时,可能需要开展单次 IV 给药的 PK 研究,以更全面地表征 PK 特性,确定非静脉给药时寡核苷酸药物的绝对生物利用度。然而,寡核苷药物生物利用度与药效(PD)或毒性相关性往往比较差,且绝对生物利用度常因药物在肝脏中的快速分布而变得复杂,因此基于血浆暴露评估寡核苷酸药物生物利用度不是一个可靠的方法。监管机构对绝对生物利用度测定的要求并不一致。
寡核苷酸药物在血浆中 PK 特征不能完全反映靶组织分布、药效学特征,呈现出血浆 PK 特征和药效 PD 脱节效应。单次给药 24~48h 后,血浆浓度很低但药效持续数十天到数月。此外,血浆动力学和靶组织效应动力学过程在时间上不一致,血浆达峰时间和最大效应时间通常存在滞后性,即短时间血浆暴露在组织中产生长期效应。
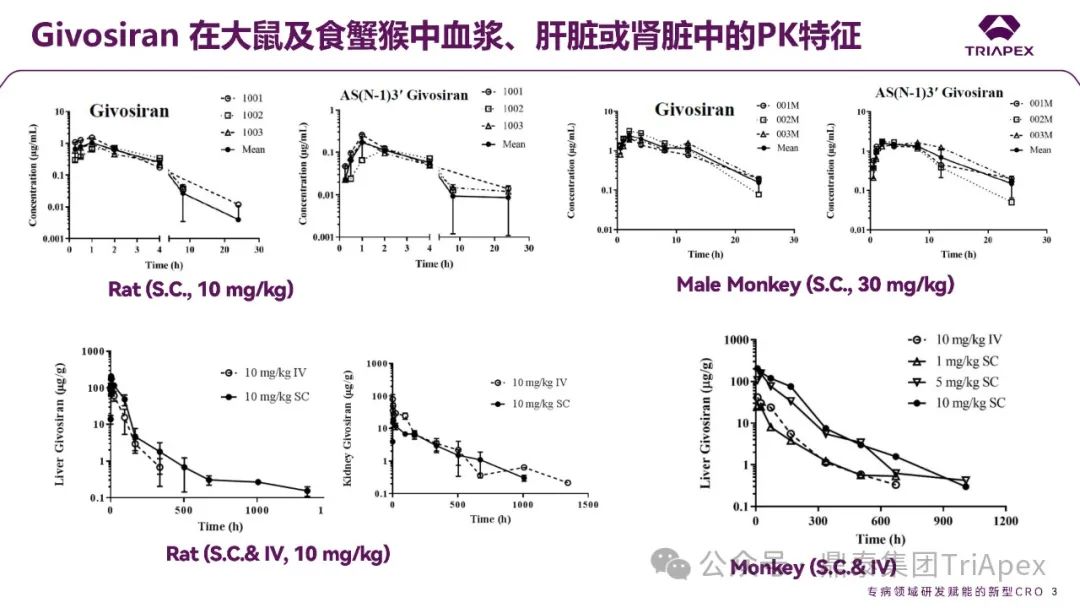
图3. Givosiran 在大鼠及食蟹猴中血浆、肝脏或肾脏中的 PK 特征[3]
二、分布
分布研究的主要目的是确定器官和组织中寡核苷酸药物绝对和相对(与毒性或活性的靶器官相比)暴露量特征,了解组织 PK/TK 与 PD 和/或毒性关系,在非临床和临床方案中指导给药频率和/或 PK/PD。
2.1 体外血浆蛋白结合
与小分子药物作用不同,寡核苷酸与血浆蛋白结合位点为亲水性结合位点(小分子药物:疏水性结合位点),结合亲和力本质上基于电荷间相互作用,通常较低且结合短暂。siRNA 与不同种属的血浆蛋白结合率(PPB)相似,且呈现一定浓度依赖性(图4)。根据 ICH M3(R2),建议在 IND 申请前或 Ⅰ/Ⅱ 期研究期间获得 PPB 数据。
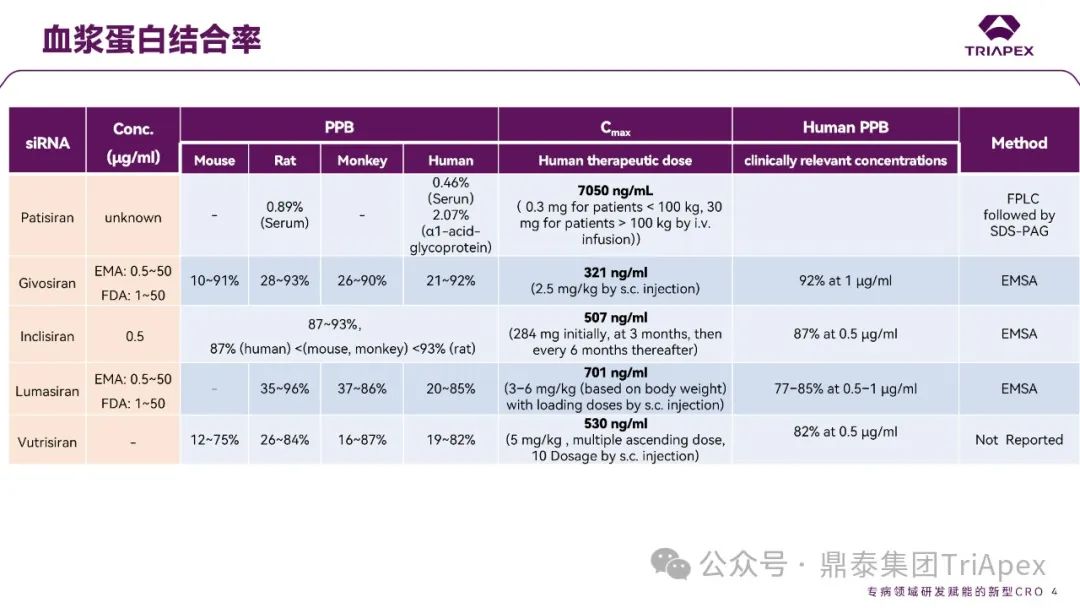
PPB 对 LNP 纳米颗粒性质、ASPGR 介导的肝细胞摄取、处置、肾脏的清除影响较小。此外,寡核苷酸药物通过 LNP(如 Patisiran)或 GalNac 介导的途径摄取进入肝脏,几乎不受 PPB 影响。摄取进入肝脏后,胞浆中游离药物浓度取决于内体中药物稳定性和逃逸效率、肝脏代谢稳定性和胞浆蛋白结合,而非 PPB。因此,无论是 LNP 还是 GalNac 修饰,PPB 数据对于 PK/PD 都没有明显影响。文献报道显示 siRNA 药物血浆蛋白结合率高时,可能会短暂延长部分凝血活酶被活化时间和补体激活时间。某些 siRNA 激活补体,可能与 LNP 递送有关,而非寡核苷酸本身。
2.2 组织分布
目前,寡核苷酸药物基于肝靶向设计,LNP- 及 GalNAc- 修饰寡核苷酸药物靶向于肝脏,肾脏、淋巴结等肝外组织水平较低。SC 给予药理学剂量水平 siRNA 时,与肝脏分布相比,肾脏分布较低(约低 25 倍)。一旦进入体循环,siRNA 药物迅速摄取进入肝脏,在肝脏中 8~24 小时达峰(Tmax,大鼠:4~8h、猴:8~24h),晚于血浆达峰时间、在肝脏中半衰期比血浆中半衰期长。Lumarisan 在 SD 大鼠及猴肝脏中 Tmax 分别为:6h(血浆:1h)、48h(血浆:2.4h),半衰期(t1/2)分别为 105h(血浆:1h)、409h(血浆:2.6h)。GalNAc- 修饰寡核苷酸药物药效与 RISC 复合物中寡核苷酸药物浓度及在肝脏半衰期直接相关,是在不频繁给药情况下实现长效作用的关键。
全身给药(IV 和 SC)时,需进行广泛组织分布评估,如肾和肝等高摄取组织,特异性靶器官分布也是必要的,通常评估 4~7 个时间点以确定组织半衰期,时间点包括血浆 Tmax、组织 Tmax,理想情况下约为 4~5 个组织半衰期;因此,研究可能会持续相当长的时间,尤其是稳定性高的寡核苷酸。
局部给药时,应确定与给药部位相关的组织分布特征(如,IVT:玻璃体液和视网膜层,IT 或 ICV:CSF、脑和脊髓段等)。取样时间,应仔细考虑缓慢释放或储备效应。局部给药后可能出现长时间全身暴露(尽管可能较低)。
若开展放射性标记组织分布研究,放射性标记的位置应考虑到代谢和潜在短链物质。为确保稳定性,通常在寡核苷酸每个分子上标记 1~2 个碱基。虽然放射性标记法评估组织分布比非放射性标记法有一定优势,但价格更昂贵且时间成本更长。若开展,经典方法是大鼠定量全身放射自显影(QWBA),但放射性结果不能区分活性原药(或活性代谢物)和非活性代谢物。
三、代谢
通常情况下,寡核苷酸药物主要经广泛分布于血浆和组织的核酸内切酶(Endonucleases)和核酸外切酶(Exonuclease)代谢,水解磷酸酯键形成核苷酸片段,而非 Ⅰ 相和 Ⅱ 相代谢酶转化形成。种属间核酸酶在结构和功能上较为保守,因此,寡核苷酸药物在不同种属间代谢途径和代谢产物相似(图5、图6)。由于不同种属间代谢的一致性,人体特有的代谢物或在人体中比在动物试验种属中存在不成比例的更高水平的代谢物(不成比例的人体代谢物)的可能性远远低于小分子。
寡核苷酸药物代谢研究可通过信息调研、风险评估或体外/体内代谢研究开发数据等。如动物组织代谢物数据可用于靶向结合、亦可测定组织/尿液代谢物,帮助预测潜在人体代谢物。
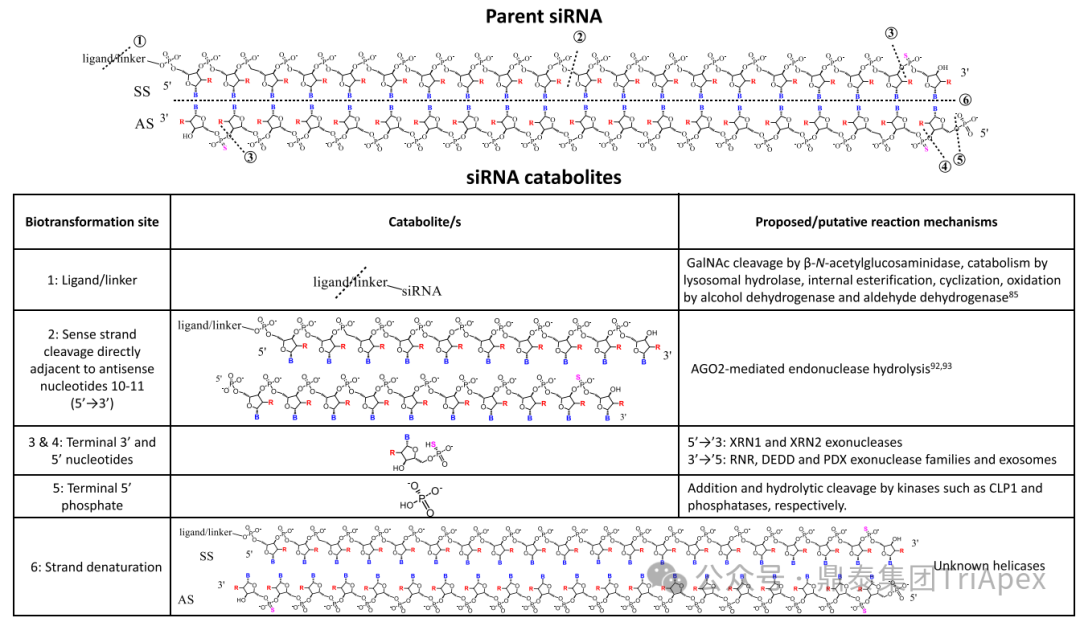
图5. siRNA 药物在体内生物转化机制[2]
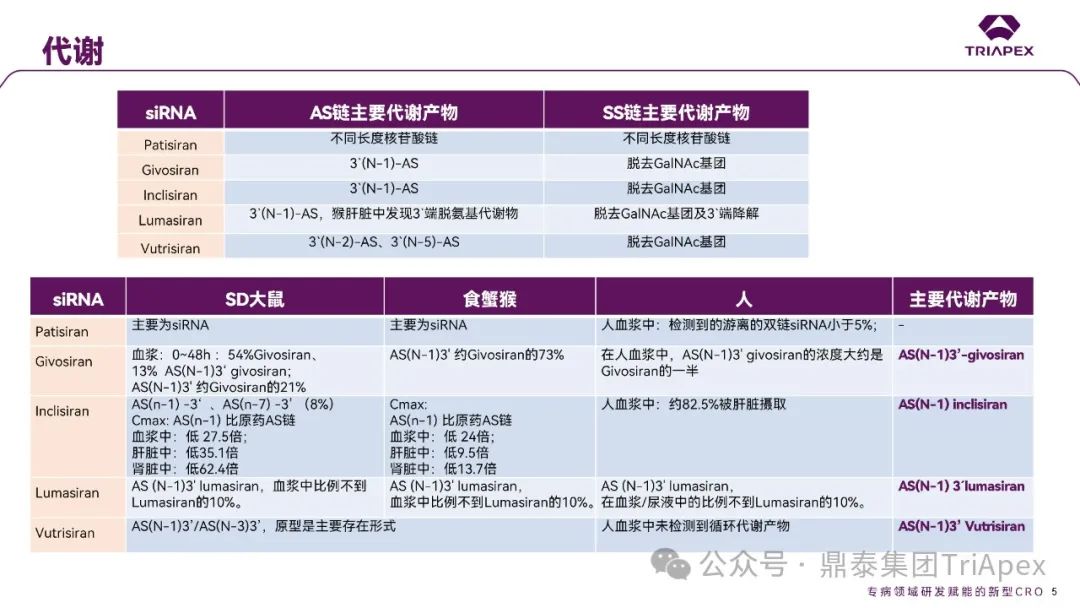
图6.部分已上市 siRNA 在体内生物代谢
◆ 体外代谢稳定性研究
通过种属间比较,确定代谢速率差异,更好地了解可能影响体内代谢的序列和化学修饰。
◆ 体外代谢物鉴定
由于种属间代谢途径一致性,寡核苷酸药物体外代谢物数据对提供临床安全性价值较小,因此体外代谢物鉴定不是必须要测定的数据。但是体外研究可提供可能的体内代谢初步评估,通常使用啮齿动物、非啮齿动物和人基质开展体外研究。肝细胞提供最接近体内肝细胞特定区域的摄取,但是寡核苷酸药物如何摄取进入肝细胞是一个亟需解决的问题;相对体内,肝脏 S9 或组织匀浆可能会导致寡核苷酸药物暴露于不相关区域,过分暴露于核酸酶中。
◆ 体内代谢
体内代谢研究主要目的是确定代谢物,并确保人血浆中代谢物的安全性,建议至少在长期临床试验之前(如 Ⅲ 期临床)测定体内代谢物。代谢物评估主要基质是血浆和尿液。此外,基质的选择应基于主要递送器官或药效靶组织,如肝脏、肾脏和给药部位。靶器官中代谢物暴露量更能准确评估组织靶向特异性递送的寡核苷酸药物。放射性标记研究通常不用于寡核苷酸的代谢物评估。
◆ 代谢物安全性测试
尽管发生率可能性很低,FDA MIST 指南适用于寡核苷酸药物。若比较发现任何特有的或不成比例的人代谢物(即在非临床安全性评估未定量的代谢物),则应对其进行考虑,以确定是否有必要进一步进行非临床研究评估其毒性。鉴于寡核苷酸不通过 Ⅰ 相代谢途径代谢,故几乎不需要担心化学反应性代谢物。
四、排泄
开展非临床排泄研究是为更好指导临床研究设计,以确定原药及其代谢物的代谢和消除途径,有助于决定是否在肾脏和/或肝脏损害患者中开展临床研究的必要性。寡核苷酸在组织驻留时间较长,在人体中开展放射性标记的质量平衡研究可能不符合伦理。非临床排泄研究可以用来代替人体质量平衡研究。一般来说,寡核苷酸的排泄途径往往不那么复杂,大多数寡核苷酸主要通过组织代谢消除,通常只有一小部分作为原形形式排出体外。肾脏排泄程度取决于 PPB 的程度。建议在长期临床试验(如 Ⅲ 期临床)之前确定排泄情况。同时,可基于平台方法,确认平台中新化合物排泄研究程度。即,若初步研究证实的结果与使用该平台的先前化合物获得结果相似,则不需要对排泄进行深入表征。
五、药物相互作用
寡核苷酸药物基于主要 CYP 酶和药物转运体、血浆蛋白结合率等直接引起相互作用可能性较小,但需关注药物作用机制。目前尚缺乏针对特定类型的寡核苷酸药物总体建议,建议根据作用机制全面评价对联合药物的潜在影响,充分评估之间的相互作用。
建议基于平台方法对寡核苷酸药物开展 DDI 研究。对于寡核苷酸药物骨架的化学结构、偶联物和/或制剂将至少证明一次体外 DDI 可能性。若结果为阳性,则应对该类型的后续寡核苷酸药物开展体外 DDI 研究。寡核苷酸的代谢产物主要是短链产物,DDI 提出应该通过对寡核苷酸药物评估,对寡核苷酸药物代谢产物 DDI 的评估通常是不合理的。
基于现有小分子药物和蛋白质治疗药物 DDI 指南和文献,以及 FDA/EMA 迄今批准的 siRNA 药物已公开信息,对 siRNA 药物 DDI 风险评估建议 DDI 决策树如图7所示。将药物代谢酶、转运体或其他蛋白质纳入 siRNA 的 DDI 评估,考虑 siRNA 和偶联物的化学结构、赋形剂的化学性质、靶标、疾病状态和疾病缓解策略,以及靶基因敲除对药物代谢酶的潜在上游或下游的转运蛋白或 siRNA 相关蛋白(如 GalNAc-siRNA 和 Ago2 的 ASPGR)。
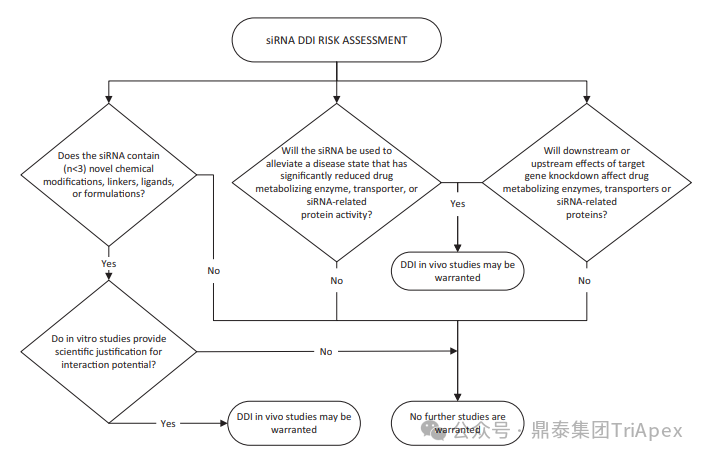
图7. siRNA 药物 DDI 风险评估建议决策树[4]
5.1 代谢介导的 DDI
寡核苷酸药物处置不是经肝脏 Ⅰ 相和 Ⅱ 相代谢酶代谢,即不经细胞色素 P450(CYP450)酶代谢。一般而言,寡核苷酸药物对 CYP 酶不调节或调节作用较小,基本不受 CYP 酶抑制剂或诱导剂影响。Patisiran 对 CYP2B6 有轻度诱导作用,但诱导能力低且 CYP2B6 底物数量有限,在临床显示产生相互作用可能性较小。寡核苷酸药物(不包括递送部分)由内切酶和外切酶代谢,目前未发现是 CYPs 或 UDP- 葡萄糖醛酸转移酶等常见药物代谢酶的底物。因此,体外 DDI 评估寡核苷酸作为药物代谢酶底物是不必要的。然而,对于偶联的寡核苷酸及 LNP 包裹型寡核苷酸(含新型成分),底物研究可能是必要的。
5.2 转运体介导的 DDI
对于寡核苷酸药物吸收、分布和排泄不太可能在主要转运蛋白抑制剂产生,无论类型、化学性质、长度、偶联性等,鲜有证据表明其是参与跨膜运输的转运蛋白主要家族的底物。因此,建议至少评估寡核苷酸药物作为可能参与组织分布和/或清除途径的特定转运蛋白的底物研究。
尽管报道有限,与小分子药物同服时,寡核苷酸药物偶联物或制剂成分可能通过非特异性结合竞争转运蛋白的活性位点,影响转运蛋白空间位阻。研究表明,虽然 IC50 远远大于临床相关的游离血药浓度,但某些寡核苷酸确实是药物转运体的抑制剂。因此,建议对转运蛋白组的抑制作用进行评估。此外,对于局部给药的寡核苷酸药物,需考虑研究给药位点有关的转运蛋白。
5.3 机制和疾病相关 DDI
应考虑基于药效、间接疾病相关的药物相互作用,或直接抑制和诱导,如 ASPGR 和 Ago2 等 siRNA 相关蛋白的相互作用。当引起 PD 效应,调节药物代谢酶(如 CYPs 和转运蛋白)表达的生化途径时,基于机制的直接效应是可能的。
FDA 关注寡核苷酸药物可能以间接方式影响 CYP 活性,如干扰血红素合成、降解或细胞因子的调节等。建议对 CYPs 和转运蛋白的潜在影响以及预期临床适应症中 CYPs 和/或转运蛋白表达的调节开展全面文献调研,并根据需要开展相关研究。
由于寡核苷酸药物 PD 效应持续时间长,药物代谢酶表达和/或活性调节的效应都可能被延长。所以,与治疗指数低且是 CYPs 或药物转运体底物的同服药物尤其重要。通过了解靶基因敲除的上游和下游效应和/或预测的脱靶沉默效应,对寡核苷酸药物的基于机制的效应介导的 DDIs 的潜力进行逐一评估。
结语
随着寡核苷酸药物研究的深入,药代动力学的重要性愈发凸显。全面的 ADME 机制研究对于寡核苷酸药物的发展是必要的,从靶点设计、结构及修饰、递送系统等多维度支撑寡核苷酸药物的药代动力学研究策略,以全面确保药物安全性和有效性。
本文主要介绍寡核苷酸药物药代动力学一般特征,并对药代动力学数据进行了总结和分析。致力于通过对寡核苷酸药物药代动力学数据分析及法规指导原则学习领悟,由点及面,助力了解寡核苷酸药物临床前药代动力学研究及实验设计的要点。期望通过本文的探讨,为相关领域研究提供一些新的视角与启示。
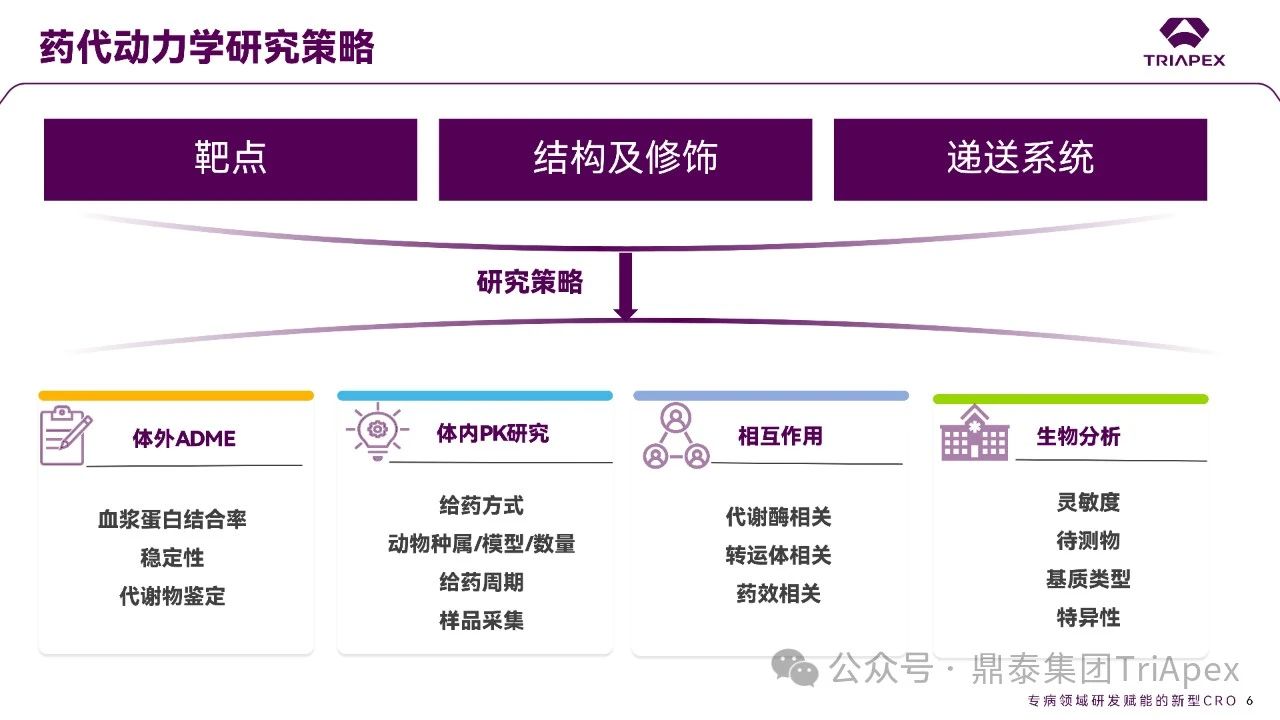
目前,鼎泰集团TriApex已建立完善的体内及体外寡核苷酸药物药代动力学研究一体化平台,助力临床前与临床转化研究的深度衔接。遵循 FDA/EMA/NMPA 法规,鼎泰集团可提供全方位的、完备的支持早期发现和分阶段支持 IND/NDA 申报所需的药效学、药代动力学和毒理学等核心研究。鼎泰集团夯实在药物开发领域的差异化优势、关注最新法规政策解读(点击查看往期文章)。凭借对药物的独特的思考角度和卓越的技术服务能力,正为药物研发注入强大动能。
供稿:DMPK 部
参考资料:


































































































































