


当传统给药方式如同隔着“护城河”向“城堡”内“盲投”药液时,中枢神经系统(CNS)直接递送技术则像一套精密导航的“微型潜艇”—— 搭载药物穿透生理性屏障的阻碍,直抵以 CNS 为靶点的核心部位(如脑实质、脑室或脊髓等)……
全文共:8162 字 10 图
预计阅读时长:20 分钟
人体 CNS 系统存在三大生理性屏障:血脑屏障(Blood-Brain Barrier, BBB)严格控制物质从血液进入大脑;血-脑脊液屏障(Blood-Cerebrospinal Fluid Barrier, BCSFB)控制着物质从血液进入脑脊液的途径;脑脊液-脑屏障(CSF-Brain Barrier)限制了脑脊液中的物质进入大脑实质;三大生理性屏障使药物递送至特定脑区成为难题。
CNS 直接递送技术(如鞘内、脑室、脑实质等)是突破血脑屏障限制、实现药物精准递送、减少外周毒性的核心手段(见图1),被逐渐广泛应用于生物药物递送,如寡核苷酸类药物和 CGT 类治疗药物等。
这类给药方式与系统给药相比能使 CNS 中药物浓度迅速升高,无需大剂量给药,这使一些大剂量下系统给药高毒性的药物(如Gliadel®)有了用武之地;同时,脑脊液和脑实质之间的自由交换和 BBB 抑制药物进入外周循环,保证了药物在 CNS 内高浓度,全身暴露量低,潜在的系统毒性低,也降低了生物药物的免疫反应风险,这些优势使 CNS 疾病的高效、安全治愈成为可能[1]。

图1. CNS 直接递送给药方式示意图[2]
1:脑实质注射(ICM);2:脑室注射(ICV);3:延髓池注射;4:鞘内注射(脊髓颈段,IT);5:鞘内注射(脊髓腰段,IT)
截至 2025 年 4 月,已获批的寡核苷酸类药物中有 10 种(共 21 种)适应症为 CNS 相关疾病,其中有 2 款药物(Nusinersen 和 Tofersen)采用鞘内注射的递送方式;AAV 类基因治疗药物中有 2 种(共 8 种)适应症为 CNS 相关疾病,1款药物(Upstaza)采用脑实质(壳核)注射的方式;此外,有 9 款 CNS 直接递送给药的药物正处于临床试验阶段(图2)。
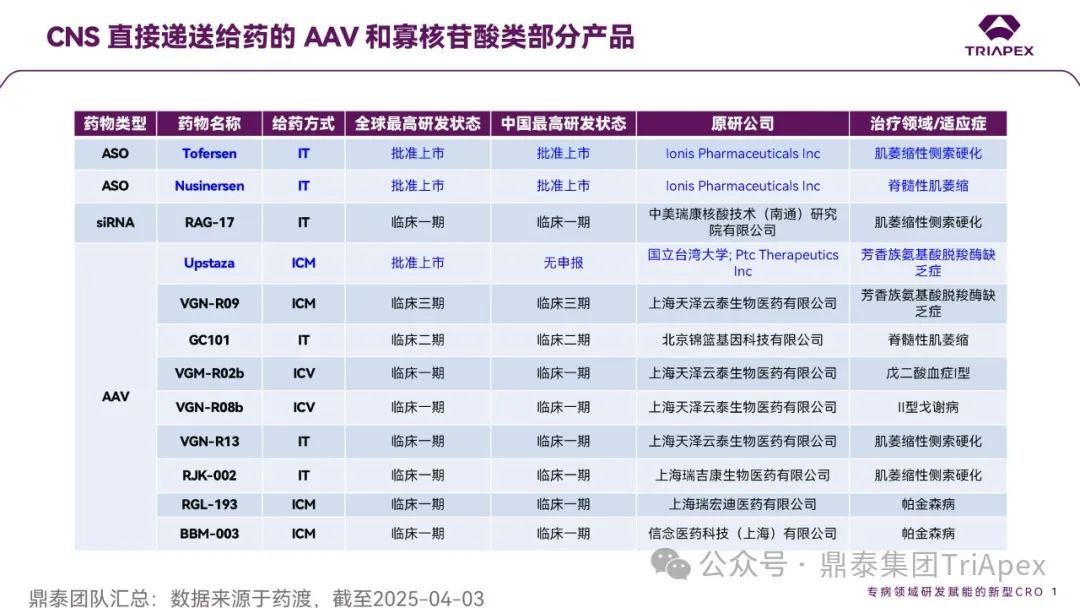
图2. CNS 直接递送给药的 AAV 和寡核苷酸类部分产品(已上市/临床试验)
本文将回顾已上市及正在进行临床试验的 CNS 直接递送药物,总结与 CNS 直接递送给药相关的一线经验,讨论该类药物非临床安全性研究的潜在毒性风险,助力 CNS 药物非临床安全性评价。由于我们的经验和技术难以覆盖所有项目的研究需求,也期待以此种方式与行业同行沟通交流,并希望我们持续提升改进。
★ 文章导览★
01 | 鞘内注射 |
02 | 脑实质注射 |
03 | 脑室注射 |
04 | 结语 |
05 | 鼎泰集团中枢神经系统直接递送给药平台技术能力 |
鞘内注射
鞘内注射(Intrathecal injection, IT)是指通过腰椎穿刺的方式,将药物直接注射至蛛网膜下腔从而使药物弥散在脑脊液中的给药方法。从给药途径层面可分为经枕骨大孔置管给药、腰椎穿刺直接给药和腰椎穿刺置管给药等,从递送药物方式层面可分为外部式给药、半植入式及全植入式给药[3]。腰椎穿刺时穿刺针依次穿过皮肤、棘上韧带、棘间韧带、黄韧带、硬膜外腔、硬脊膜、硬膜下间隙、蛛网膜,最后到达蛛网膜下腔。
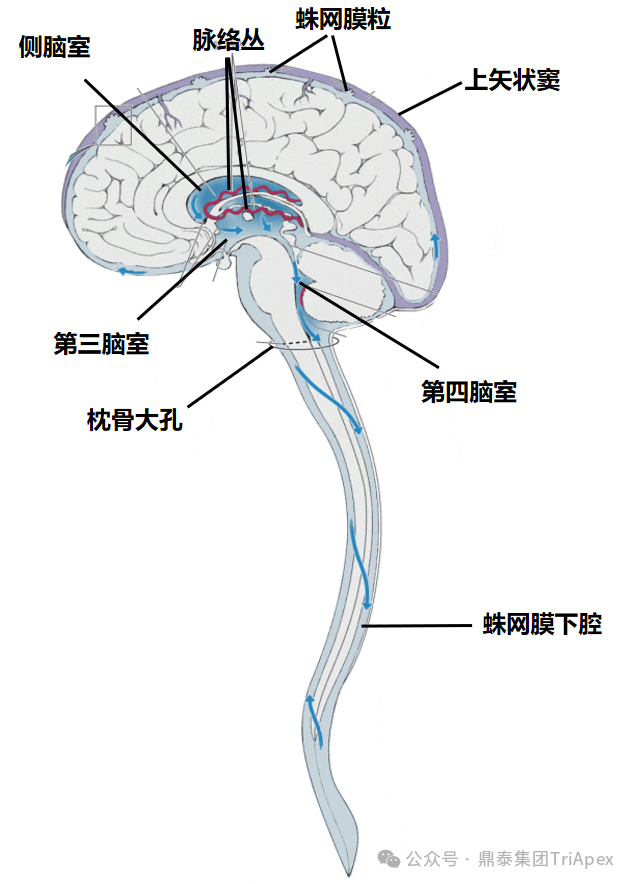
图3. IT 给药后药物流向示意图
1. 给药部位和成功标志
非临床(犬、猴)腰椎穿刺直接给药部位为 L3~L4/L4~L5 椎间隙(此处为游离马尾神经,不易损伤脊髓),这两者腰池体积更大,易进针。
成年猴一般在 L3~L4/L4~L5 腰椎间隙穿刺,幼龄猴一般选择 L2~L3/L3~L4 腰椎间隙,成功标志为清亮脑脊液溢出,注射后停针操作 5~10 min(头部为低位)
大、小鼠则通常以 L5~L6 为穿刺部位,成功标志为明显的甩尾动作
兔通常以 L6~L7 为穿刺部位,成功标志位脑脊液流出
2. 重复 IT 给药关注点
某些 IT 注射药物常需重复给药(如 ASO/siRNA),因此需评估药物重复注射耐受性和局部刺激性。研究表明,醋酸齐考诺肽经重复鞘内注射可能引起局部刺激性,需对注射点机械损伤和组织病理学改变进行严格监测[4]。临床 IT 给药可酌情使用超声或其他成像技术辅助,且需要提前关注患者的颅内压,注射完成后建议仰卧位至少保持 30 min~1 h,双脚抬高(头部处于低位),以促进药物渗透到脑室中,避免其在脊髓中长期存在,从而避免其通过静脉椎丛吸收到血液中。
3. IT 给药优、劣势
IT 给药的主要优势在于药物直接作用于 CNS,避免了通过血液循环到达靶点的全身性暴露,从而提高了治疗效果并减少了副作用。研究表明,IT 后 CSF 药物浓度可达静脉给药的 100 倍以上,且由于 CSF 体积小于血液(140 vs 3500 mL),药物半衰期较血浆长[5],如巴氯芬 IT 给药可显著降低药物用量并提高对痉挛性脑瘫患者的治疗效果[6]。临床 IT 主要劣势在于可能引起多种并发症,如穿刺后头痛、腰痛、感染或出血,且药物可能注射或泄露到硬膜下或硬膜外腔(临床发生率为10%)[5],因此 IT 重复给药的临床依从性很差,通常通过联合静脉注射给药的方式显著提高患者依从性以及改善长期预后情况[7],且对于婴幼儿和脊椎发育畸形的患者来说,给药操作难度很高。
在非临床研究中,IT 给药的主要劣势在于可能引发神经毒性、化学性脑炎及注射部位病理改变(脊神经根刺激),如 Nusinersen 在幼龄猴实验中高剂量组可见急性短暂低位脊髓反射缺陷、重复给药后药物蓄积引起的神经元空泡化和坏死、学习和记忆检测中的神经行为学缺陷,且大体积给药可能导致颅内压升高引发恶心、呕吐。除此之外,还会带来一些常见的病理学改变:脊髓(注射部位)轴突变性、胶质增生、炎性细胞浸润、神经纤维变性和肉芽肿等;脑部出血、胶质增生、单核细胞和巨噬细胞浸润等;坐骨神经轴突变性和神经纤维变性等[8]。
4. 已上市代表性药物:Nusinersen和Tofersen
◆ Nusinersen
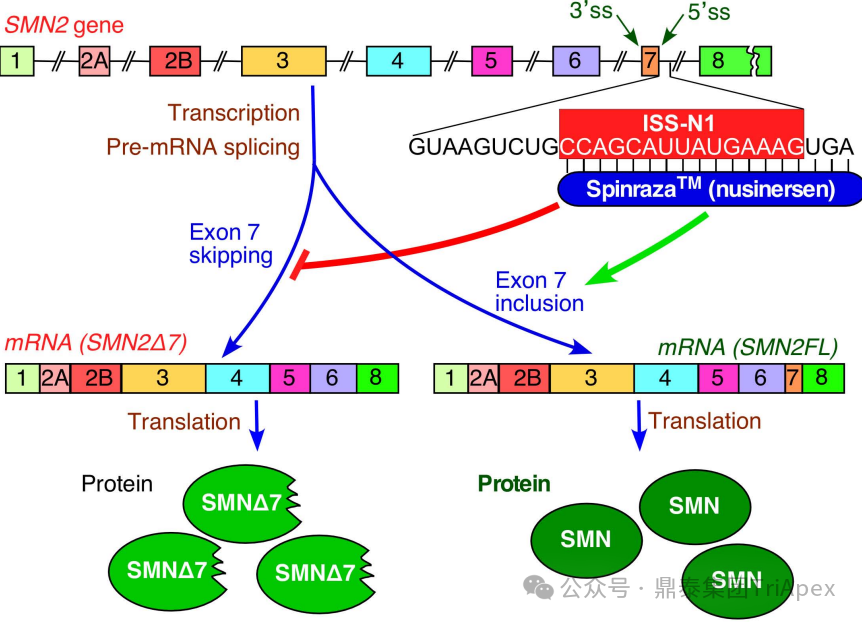
图4. Nusinersen 作用机制示意图[9]
诺西那生钠注射液[10](Nusinersen)是一款用于治疗脊髓性肌萎缩症(Spinal Muscular Atrophy, SMA)的反义寡核苷酸(ASO)药物。SMA 是由于运动神经元存活基因 1(Survival Motor Neuron 1, SMN1)缺失或突变引起全长 SMN 蛋白缺乏而导致中枢神经系统、外周神经系统和骨骼肌运动神经元丢失的一种遗传性神经肌肉疾病,临床表现为进行性肌无力和肌萎缩。
Nusinersen 的结构与内源性 RNA 相似,是一种 18-mer 的 ASO,特异性高,可与人类 SMN2 的前 mRNA 互补和杂交,增加 SMN2 转录中的 7 号外显子,以增强全长 SMN 蛋白的表达。运动神经元的细胞体主要位于皮层、脑干和脊髓中,其轴突投射到脑干、脊髓或外周肌肉中,从而控制运动、呼吸和吞咽等重要功能[11]。药效研究显示,Ⅰ 型 SMA 的 SMNΔ7 小鼠模型通过直接将 Nusinersen 注射入 CSF 中,可以延长动物存活时间以及保护 α-运动神经元和预防骨骼肌病理(保留神经肌肉连接形态、增加肌纤维大小)。通过 IT 给药,Nusinersen 可广泛分布于整个脊髓和大脑,其中在脊髓神经元中浓度最高,且连续给药 7 天后药物在脑和脊髓中持续时间至少为 24~36 周。IT 直接将药物递送到脊髓周围的脑脊液中,使其直接作用于运动神经元的胞体中,实现高效治愈 SMA,这体现出 Nusinersen 通过 IT 给药的极大药效优势。
◆ Tofersen
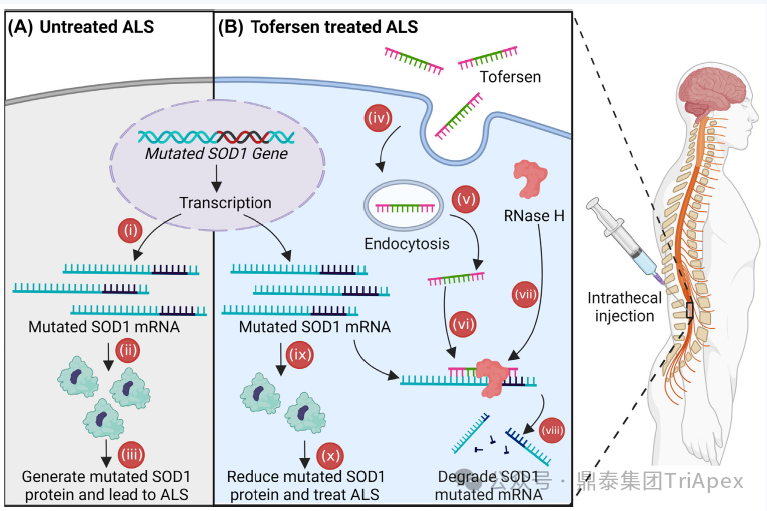
图5. Tofersen作用机制示意图[12]
托夫生注射液[13](Tofersen)是一款用于治疗肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)的 ASO 药物,ALS 是一种进行性致命的神经退行性疾病,影响大脑和脊髓中的运动神经元,导致肌肉无力、瘫痪,最终导致死亡。Tofersen 通过与突变的 SOD1 基因 mRNA 结合,利用核糖核酸酶 RNase-H 介导的降解机制,靶向并降解突变的 SDO1 mRNA,特异性减少突变 SOD1 蛋白的产生,从而保护大脑和脊髓中的运动神经元,该药与 Nusinersen 的给药方式一致,均是由于作用靶点-运动神经元位于 CNS,这种精准靶向的给药方式能有效减少毒性 SOD1 蛋白的街垒,从而减轻运动神经元的损伤并延缓 ALS。
◆ 毒理学评价关注点
在非临床研究中,两种药物通过 IT 注射均发现了一些毒性风险,如神经元空泡化、神经元和胶质细胞坏死以及注射部位可见单形核细胞浸润、空泡和嗜碱性颗粒的巨噬细胞浸润等[14]。临床资料显示,Nusinersen 可见呕吐、背痛、头痛、血小板减少和肾毒性风险,其中前 3 种可能为腰椎穿刺术相关不良反应;Tofersen 可见脑脊液白细胞增多、脊髓炎、无菌性脑膜炎、颅内压升高、肌痛、关节痛、等风险,其中前 4 种可能为给药相关不良反应。基于此,在进行以上 2 款药物的给药需关注患者脑积水情况(颅内压)、脊柱影像等等,尤其是 Nusinersen 多适用于幼龄患者,脊柱发育尚不完全,应酌情使用超声或其他成像技术辅助鞘内注射。
植入置管是实现重复给药的有效方式之一,但这通常存在一定的手术风险,并且在长期的置管过程中可能会发生 CNS 感染,严重的会引起脑膜炎;还有可能发生导管移位或堵塞,从而影响药物的递送效果[15]。侵入式给药方式(腰椎穿刺)也可能会导致注射部位疼痛或神经组织损伤。在进行非临床毒性评价时,均需关注给药局部刺激性,包括注射点可逆的机械性损伤和组织病理学检查[4]。
脑实质注射
脑实质注射(Intracerebral injection, 歧义缩写可忽略)是一种将药物直接注入大脑特定区域(如海马体、纹状体、皮层、基底节、丘脑等)的给药方式。这种技术常用于神经科学的研究中,利用脑立体定位仪通过微细给药针头实现对目标脑区的精准干预。
1. 精准定位给药部位
非临床研究中,ICM 注射部位的选择基于科学研究的试验目的,如需针对特定脑区(如纹状体/海马体)进行研究,可通过磁共振成像(MRI)兼容的脑立体定位仪精准测定坐标,确保药物注射到目标区域。临床上以治愈患者为目的,注射部位的选择需根据患者的具体情况,如病变部位、脑组织结构内,以确保药物能够精准到达目标区域。
2. 适用性
ICM 适用于需要快速达到局部(如纹状体/海马体)高浓度药物的治疗场景,如某些脑肿瘤或脑卒中患者的治疗,对于颅内压增高或出血性脑卒中患者,不建议进行此类注射,以免加重病情。同时,ICM 对于病变范围累及脊髓全长、脑干及皮层的 CNS 疾病亦不适用。临床操作前应对患者进行充分评估,如颅内压检测、脑积水情况检测等,防止出现并发症(感染、脑水肿),注射后要密切观察患者状况,并及时处理并发症;非临床研究中需评估注射过程中的潜在风险,包括局部出血、感染或神经损伤等,此外,注射后需观察动物的行为变化,以评估药物对 CNS 的影响。
3. ICM 给药优、劣势
ICM 将药物直接输送到特定脑区,避免了血脑屏障的限制,从而提高药物在脑内的分布浓度,如治疗脑肿瘤时可显著提高药物在肿瘤区域的浓度,从而增强疗效[21];如在急性缺血性卒中患者中,与静脉注射相比,颅内注射显示出更明显的疗效;如已上市药物 Upstaza 在对比了 ICM、ICV、IT 三种给药方式后发现 ICM 在目标脑区药物暴露量最高。这些充分展示了 ICM 用于特定脑区给药的药效优势[16]。
ICM 是一种侵入性给药方式,依托于精确的定位和规范的操作,给药过程要求全程无菌,手术风险较高,操作不当可能会出现药物难以扩散到临近区域,影响治疗范围;此外可能出现一系列并发症,如感染、出血、脑损伤、脑水肿等,同时可能导致短暂的低温和伤口疼痛,在临床上病人的依从性较差,非临床可能会引起炎症反应、神经元损伤、胶质细胞增生、出血等改变[8]。
4. 代表性药物:Upstaza
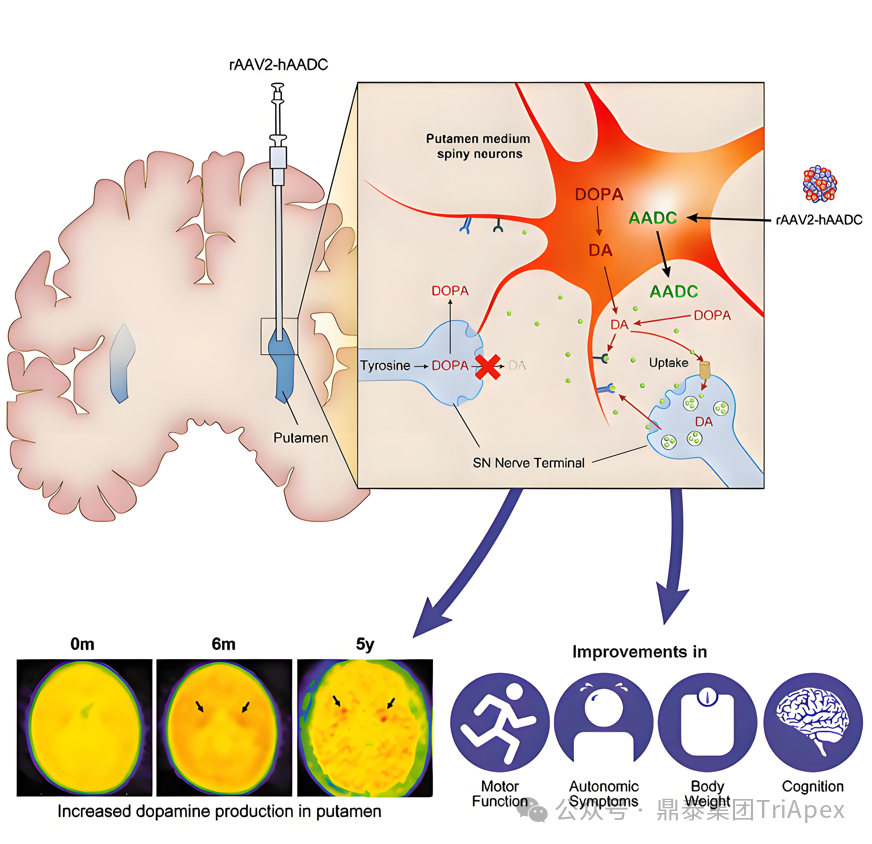
图6. Upstaza 机制示意图[17]
Upstaza 是由 PTC Therapeutics 公司开发一种创新的基因疗法(腺相关病毒2型,AAV2),用于治疗 18 个月及以上的芳香族 L-氨基酸脱羧酶缺乏症(Aromatic L-amino Acid Decarboxylase Deficiency, AADC)。AADC 是一种罕见的常染色体隐形遗传疾病,由 DDC 基因[18](于纹状体中表达稳定)的突变引起,这些突变导致 AADC 酶活性降低或缺失。AADC 酶负责将 L-3,4-二羟基苯丙氨酸(L-DOPA)和 5-羟色氨酸(5-HTP)分别脱羧形成多巴胺和 5-羟色胺,这些神经递质对于控制自主神经系统至关重要。患者可能会出现运动功能障碍、情绪障碍、睡眠障碍以及其他症状。
Upstaza 作为全球首个直接注入大脑的基因疗法,通过结合 MRI 执行脑立体定向外科手术将功能性 DDC 基因直接地送到患者大脑的壳核区域(DDC 基因可稳定表达,传导中等棘状神经元),增加 AADC 酶并恢复多巴胺的产生,以纠正潜在的遗传缺陷。
在一项幼龄猴的非临床安全性研究中,采用了 ICM(壳核、1.2×1010 vg)、ICV(1.2×1011 vg)、IT(1.2×1011 vg)三种给药方式,结果显示三种给药方式动物均有良好的耐受性,且尽管 ICM 使用的剂量时后两者的 1/10,药物经过壳核 ICM 给药的目标壳核区域的表达仍显著优于 ICV 和 IT 给药,因此最终选用 ICM 作为本款药物最有效安全的给药方式。
临床资料显示,受试患者在接受该疗法 3 个月后即可观察到具有临床意义的运动功能及认知能力改善,并且这一改善可持续至少 10 年;常见的不良反应为初期失眠、易怒和运动障碍,暂时并未发现给药操作相关的风险警告[16][17]。
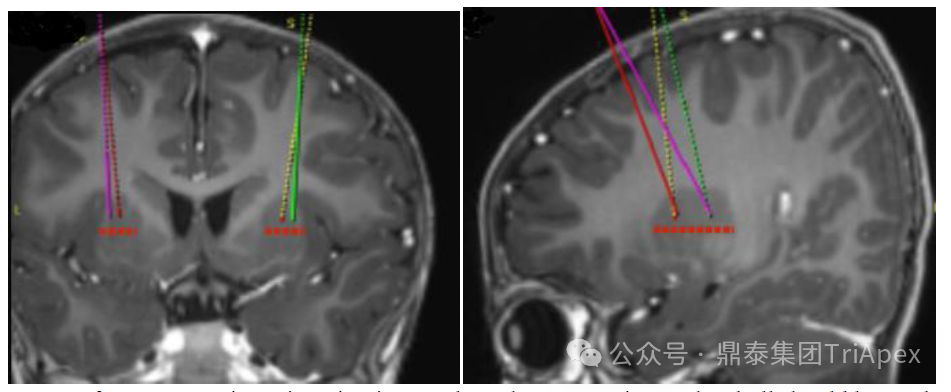
图7. Upstaza 注射液 4 个壳核注射位点示意图[16]
脑室注射
脑室注射(Intra-cerebroventricular injection, ICV)是一种直接将药物注入脑室内的给药途径。ICV 直接将药物递送至 CNS,具有分布广泛、靶向性强、效果持久的特点;注射后,药物会随着 CSF 的流动分布到整个 CNS,包括大脑皮层、脊髓等区域。
1. 精准定位给药部位
非临床注射前需通过脑立体定位仪确定坐标,并确保针插入到目标脑室的正确深度和方向,是否穿刺成功可根据 CSF 回流或回抽来判断。注射过程中需要控制速度,避免速度过快引起药物扩散不均或局部组织损伤(如产生血栓)[19]。此外还需要进行有效的术前、术中和术后护理操作,对于小动物而言,术前、中、后处理相对简单,术前主要关注麻醉剂的选择及剂量,术中使用加热垫保证小鼠体温维持在适宜范围内,术后手术区域注意进行严格的消毒处理,减少术后感染风险;NHPs 的生理解剖结构与人类更为相似,神经系统和脑结构更为复杂,因此大动物(NHPs)的术前、中、后处理要求则更为严格,不仅要全程做好消毒,保持无菌环境,还需要在术前术后给予抗感染、镇痛类药物,并密切观察动物状态,出现异常需要及时干预。
临床上为了确保药物进入目标脑区和实时监控潜在的并发症,常采用 MRI 进行辅助给药,术前扫描精准定位,术后评估可确认药物分布情况并检测患者的恢复情况。
2. 适用性
非临床研究中,小鼠的 CNS 直接给药常考虑采用 ICV 注射,因为小鼠的腰池非常小,不便于重复给药操作,而大池虽然有相对大容量的腔体,但是容易在操作过程中穿透脑干,这将破坏其存活的关键结构。相比之下,ICV 对于小鼠来说为更优给药方式。小鼠 ICV 注射的次数一般小于 5 次,防止由于累积注射导致的局部组织损伤,重复给药可以通过每次注射沿同一轨迹插入针头来最小化伤害[20]。因此,涉及到小动物直接递送至 CSF 的给药方式,一般选择 ICV,而大动物则一般选择 IT,如在 Nusinersen 和 Tofersen 的非临床评价中,小鼠药效试验采用 ICV 给药方式,而 NHPs 则采用 IT 给药方式。
当 IT 无法在脑室中达到足够的药物浓度时,通常采用 ICV 的方式。临床上使用该方式进行给药的药物主要有抗生素类、抗病毒类、化疗药物和神经保护剂和神经营养因子等,主要用于治疗 CNS 感染、神经退行性疾病(如阿尔茨海默病、帕金森病)[21]。当 CSF 循环障碍无法使用 IT 或目标区域位于脑室附近(如脑室内病变)时,通常采用 ICV,例如 ICV 注射溶栓药治疗脑室出血,较IT能更有效清除血块[22];黏多糖贮积症的酶替代疗法需通过脑室注射确保药物渗透至脑组织[23]。ICV 在临床上新生儿给药的风险较低,在成人中则较高,给药成功后药物主要广泛分布于大脑、小脑和脊髓,因此 ICV 相对来说更适合新生儿。
3. 重复 ICV 给药关注点
ICV 对于一些需要重复给药的药物适用性不强,在此基础上,Ommaya 囊应运而生,其导管插入大脑的侧脑室,可直接进入 CSF,最初设计目的是在治疗真菌性脑膜炎时进行脑室内持续给药[24]。该技术适用于需要长期治疗以及腰椎穿刺难以进行的患者(如重度脊柱侧弯),与腰椎穿刺相比,这种方式的优点是药物分布更均匀,蛛网膜下腔的药物浓度更高,可以长期留置实现反复多次引流,并且还能便于采集脑脊液进行检测[24] ,但 Ommaya 囊脑室内给药对脑实质病变的有效性有限,药物浓度在距室管膜表面几毫米处则极低。此外,植入 Ommaya 储液器可能会导致长期并发症,如导管阻塞、出血和感染。
4. ICV 给药优、劣势
ICV 给药的优势与 IT 相似,能够直接将药物输送到 CSF 中,从而提高药物在 CNS 的浓度。如在小鼠模型中,通过 ICV 注入 Nusinersen 可显著上调 CNS 中 SMN 蛋白表达,而静脉或皮下给药则在 CNS 外产生更广泛的系统性表达。相比之下,ICV 给药可直接通过 CSF 进入 CNS 组织中的运动神经元,比系统给药更为有效。
与此同时,ICV 也是一种侵入性手术(可能引发感染、颅内压升高),对于技术要求较高且药物扩散受限,这可能会限制治疗的深度和效果。除此之外,也可能导致很多病理学改变,如急性出血、神经质空泡化、反应性胶质增生、脑室扩大、单核细胞或混合细胞浸润、巨噬细胞浸润、混合细胞验证和肉芽肿形成等,这些损伤可能会带来行为和认知功能的改变[25]。
5. 代表性药物:Brineura®

图8. Brineura®机制示意图
在遗传代谢病中,尤其是涉及 CNS 受累的疾病,直接通过脑室注射递送酶成为重要策略。Brineura®是全球首个针对 CNS 的酶替代疗法,适应症为 CLN2 型神经元蜡样脂褐质沉积症。CLN2 病是一种罕见的遗传性神经系统退化性疾病,由于缺乏功能性 TPP1 酶导致溶酶体功能障碍。Brineura®通过植入 Ommaya 囊进行 ICV 给药(Q2W),通过阳离子非依赖性甘露糖-6-磷酸受体运输到溶酶体中,在溶酶体中被激活为 rhTPP1 的蛋白水解形式,恢复正常的溶酶体功能,从而减少神经元内的异常积累物质。
临床资料显示,药物输送后在 4 h左右达到最大 CSF 浓度,这保证了药物起效的及时性。在临床Ⅰ/Ⅱ期研究中,Brineura®显著减缓了 CLN2 病儿童的功能衰退进展,且在长达 240 周的治疗期内,疗效得以维持,最常见的不良反应包括发热、呕吐、头痛、脑膜炎、脑脊液蛋白增加/减少、心电图异常、癫痫发作、过敏反应等,其中前 5 种反应可能与给药操作相关[26]。
结语
对于某些经系统给药无法有效分布到 CNS 病变部位的的药物(如寡核苷酸类药物和 CGT 类治疗药物等),采用 CNS 直接递送技术(如鞘内、脑室、脑实质等)有助于突破血脑屏障限制、实现药物精准递送、减少外周毒性。CNS 直接递送给药的优、劣势主要体现在以下方面(图9):

图9. CNS直接递送给药优、劣势
尽管 CNS 直接递送方式在某些情况下效果显著,但其侵入性和操作复杂性一定程度上限制了其广泛应用。因此,如何在保持高效递送的同时降低侵入性成为研究的关键方向;比如 Arrowhead 公司通过持续创新,成功开发了两代靶向 RNAi 药物递送平台(TRiM 和 TRiP),实现了从鞘内给药到皮下给药的技术突破,这一创新不仅解决了传统 IT 的侵入性和重复操作问题,还通过非侵入性皮下给药方式实现了高效、安全的 CNS 靶向递送[27],我们在本公众号此前的文章中亦有讨论(点击查看往期文章:Arrowhead 在 CNS 疾病领域基于寡核苷酸的技术革新和实践经验)。
鼎泰集团 CNS
直接递送给药平台技术能力
在全球 CNS 药物研发热度持续攀升的行业背景下,鼎泰集团致力于为 CNS 专病领域赋能,突破传统评价给药体系壁垒,构建起 NHPs 和啮齿类动物立体定位注射技术体系,涵盖侧脑室/纹状体/海马/鞘内注射等多种给药途径;同时,整合神经行为学和在体电生理等前沿技术,开发了 AD 和 PD 等疾病模型,助力临床前与临床转化研究的深度衔接;通过十余年技术积累,鼎泰集团已为多项创新脑靶向药物提供了全面可行的非临床评价方案,积攒了丰富的给药操作经验,药物类型涵盖 AAV、ASO、siRNA、小分子,动物种属覆盖了全年龄段的大小鼠、NHPs、家兔等。通过聚焦技术难点进行服务升级的战略部署,鼎泰集团不仅提升了综合服务能力,更夯实了在 CNS 药物开发领域的差异化优势。凭借对创新技术的持续投入和卓越的技术服务能力,鼎泰集团正为全球新药研发注入强大动能。
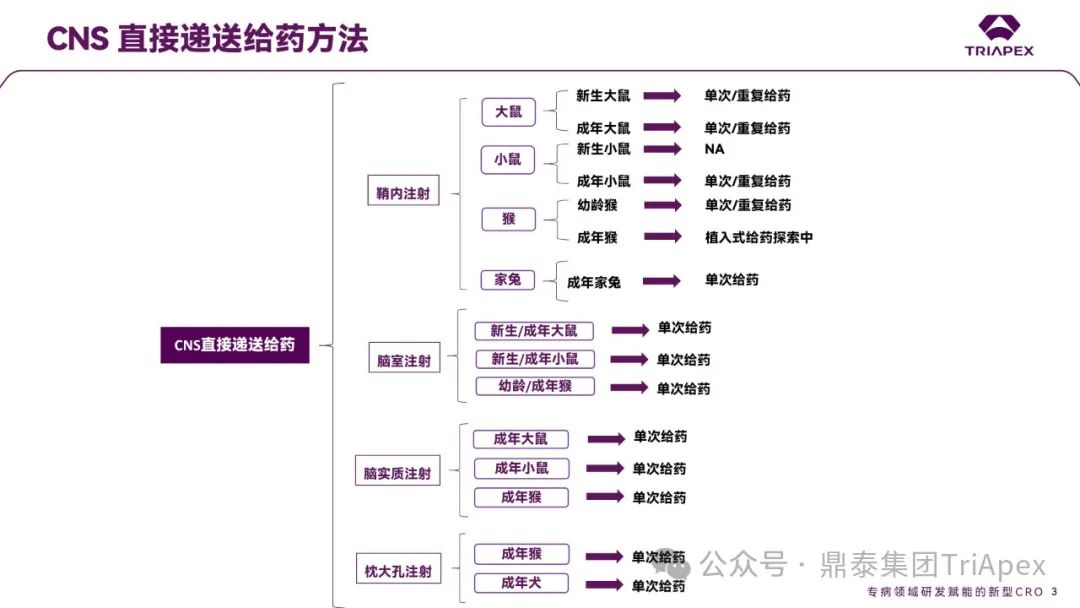
图10. 鼎泰集团 CNS 直接递送给药技术平台
供稿:毒理Ⅱ部
参考资料:
[1] Imberti R , Amatu A .Drug delivery to the central nervous system[J].European Journal of Histochemistry, 2010, 54.
[2] Gomez Limia, C.; Baird, M.; Schwartz, M.; et al. Emerging Perspectives on Gene Therapy Delivery for Neurodegenerative and Neuromuscular Disorders. J. Pers. Med. 2022, 12, 1979.
[3] 黄羽静,柳璐,雷夏凌,等.浅谈鞘内给药非临床安全性评价的关注点[C]//中国毒理学会第十次全国毒理学大会论文集.2023.
[4] 宋莹,付新录,兰天龙,等.醋酸齐考诺肽重复鞘内给药的局部刺激性研究[J].药物评价研究, 2017, 40(1):5.
[5] Triarico, Maurizi, Mastrangelo, et al. Improving the Brain Delivery of Chemotherapeutic Drugs in Childhood Brain Tumors[J].Cancers, 2019, 11(6):824.
[6] 刘建军,吴卫红,纪树荣.鞘内注射巴氯酚治疗痉挛型脑瘫的临床应用[J].中国康复理论与实践, 2003, 9(1):52-54.
[7] 乔燕燕,刘斌,路燕.常规静脉给药联合鞘内药物注射治疗急性期视神经脊髓炎谱系疾病的临床疗效研究[J].中国全科医学, 2020, 23(12):5.
[8] Berman-Booty LD, Klein SK, Mazur C, et al. Toxicologic Pathology Forum: Opinion on Interpretive Challenges for Procedure-Related Effects Associated With Direct Central Nervous System Delivery of Oligonucleotides to Rodents, Dogs, and Nonhuman Primates. Toxicol Pathol. 2023 Aug;51(6):375-389.
[9] Singh N N, Howell M D, Androphy E J, et al. How the discovery of ISS-N1 led to the first medical therapy for spinal muscular atrophy[J].Gene therapy, 2017, 24(9):520-526.
[10] NUSINERSEN Pharmacology-Toxicology Review, NDA #209531.000
[11] Vangoor V R , Gomes-Duarte A , Pasterkamp R J .Long non-coding RNAs in motor neuron development and disease[J].Journal of neurochemistry, 2021, 156(6):777-801.
[12] Jin, Jing, et al. Trends in Pharmacological Sciences, Volume 44, Issue 12, 1043-1044
[13] Al Shaer D, Al Musaimi O, Albericio F, et al. 2023 FDA TIDES (Peptides and Oligonucleotides) Harvest. Pharmaceuticals 2024, 17, 243.
[14] 冯政,岳岩,李德利,等.寡核苷酸药物非临床安全性评价的一般考虑及案例分析[J].中国新药杂志, 2024(23).
[15] Scanlon, Maura M, Gazelka, et al. Surgical Site Infections in Cancer Patients with Intrathecal Drug Delivery Devices.[J].Pain Medicine, 2017.
[16] UPSTAZA SUMMARY OF PRODUCT CHARACTERISTICS.
[17] Tai C H , Lee N C , Chien Y H ,et al. Long-term efficacy and safety of eladocagene exuparvovec in patients with AADC deficiency[J].Molecular Therapy, 2022, 30(2):509-518.
[18] Sebastian W S , Kells A P , Bringas J ,et al. Safety and tolerability of MRI-guided infusion of AAV2-hAADC into the mid-brain of nonhuman primate[J].Molecular Therapy Methods & Clinical Development, 2014, 3(C).
[19] Mathon B, Nassar M, Simonnet J, et al. Increasing the effectiveness of intracerebral injections in adult and neonatal mice: a neurosurgical point of view. Neurosci Bull. 2015 Dec;31(6):685-96.
[20] Berman-Booty L D , Klein S K , Mazur C ,et al.Toxicologic Pathology Forum: Opinion on Interpretive Challenges for Procedure-Related Effects Associated With Direct Central Nervous System Delivery of Oligonucleotides to Rodents, Dogs, and Nonhuman Primates[J].Toxicologic pathology, 2023(6):51.
[21] 赵宗彪,赵为陈,何春远,等.鞘内/脑室内注射抗菌药物治疗中枢神经系统感染的研究进展[J].中南药学,2025,23(01):174-178.
[22] Greenberg SM, Ziai WC, Cordonnier C, et al. 2022 Guideline for the Management of Patients With Spontaneous Intracerebral Hemorrhage: A Guideline From the American Heart Association/American Stroke Association. Stroke. 2022 Jul;53(7):e282-e361.
[23] D'Avanzo F, Rigon L, Zanetti A, et al. Mucopolysaccharidosis Type II: One Hundred Years of Research, Diagnosis, and Treatment. Int J Mol Sci. 2020 Feb 13;21(4):1258.
[24] 杨凯,韩珊,刘世勤,等.Ommaya囊在神经外科治疗中的研究进展[J].现代生物医学进展, 2016(16):4.
[25] Berman-Booty LD, Klein SK, Mazur C, et al. Toxicologic Pathology Forum: Opinion on Interpretive Challenges for Procedure-Related Effects Associated With Direct Central Nervous System Delivery of Oligonucleotides to Rodents, Dogs, and Nonhuman Primates. Toxicol Pathol. 2023 Aug;51(6):375-389.
[26] Markham, Anthony. Cerliponase Alfa: First Global Approval[J].Drugs: International Journal of Current Therapeutics and Applied Pharmacology Reviews, Featuring Evaluations on New Drugs, Review Articles on Drugs and Drug Therapy, and Drug Literature Abstracts, 2017.
[27] 鼎泰集团TriApex公众号:Arrowhead在CNS 疾病领域基于寡核苷酸的技术革新和实践经验,2025.


































































































































