


非小细胞肺癌(NSCLC)约占所有肺癌的85%。随着以 PD-1/PD-L1 抑制剂为代表的肿瘤免疫治疗的兴起,NSCLC 一线治疗的格局也在不断的发生变化。目前,对于 PD-L1 表达阳性转移性 NSCLC,国际上公认的标准治疗是帕博利珠单抗(Pembrolizumab,商品名 Keytruda;俗称“K药”)单药治疗。 尽管如此,帕博利珠单抗在 PD-L1 表达阳性转移性 NSCLC 的治疗中仍存在许多未满足的临床需求。在以临床价值为导向的新药研发趋势和监管背景下,针对该人群的后续产品的关键性临床试验需与帕博利珠单抗进行头对头对照。在这些研究中,康方生物的 PD-1/VEGF 双抗(依沃西单抗,代号 AK112)是第一个以优效性设计完成试验并申请上市的产品。根据 CDE 公开受理信息,依沃西单抗的 sNDA 申请(该产品申请上市的第 2 个适应症)于 2024 年 7 月 29 日获得 NMPA 正式受理,且于 2024 年 8 月 14 日获得优先审评。与 AK112-301/HARMONi-A 试验一样,该研究在万众瞩目的同时,关于其临床试验设计和试验结果的欢呼与质疑从未间断,或许这就是第一个敢为人先者所必须承载的使命吧! 历史总是惊人的相似,但已不再是简单的重复。 熟悉帕博利珠单抗的同行或许还清晰地记得,该药也恰恰是在一波三折的经历中崛起的 —— 在收购、二次收购、优先级调整、秘密研究、暂停、重启、专利诉讼中披荆斩棘。而帕博利珠单抗开始实现对当时比自己强大的竞争对手纳武利尤单抗(Nivolumab,商品名 Opdivo;俗称“K药”)逆转的标志性事件,正是在后者临床试验(Checkmate-026)失败后,它开创性地在 PD-L1 表达阳性 NSCLC 一线治疗临床试验(Keynote-024 和 Keynote-042)中的陆续成功。 因此,在本文中,我们对依沃西单抗的临床试验设计和结果不置褒贬也或许无权褒贬,只是静静地体悟一家 Biotech 在探索产品上市时的研发智慧、策略和行为对于当前医药大环境下实属不易的新药研发的些许启示。 依沃西单抗针对 PD-L1 表达阳性 NSCLC 的 NDA 申请获得受理 依沃西单抗针对 PD-L1 表达阳性 NSCLC 的 BTD 公示 依沃西单抗针对 PD-L1 表达阳性 NSCLC 的优先审评公示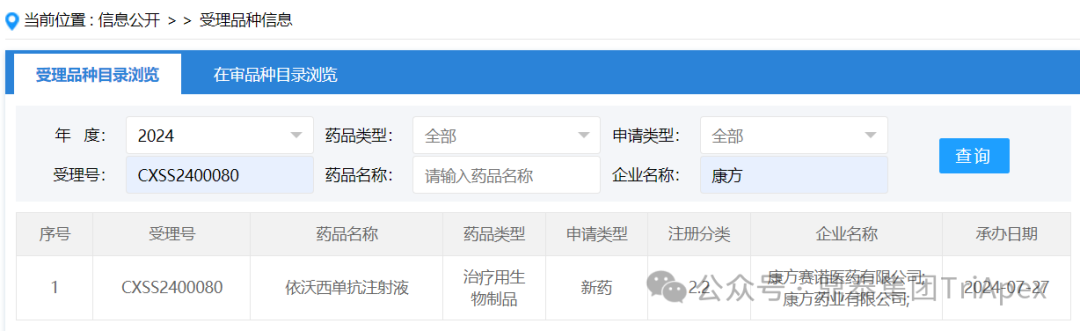

全文共:6749 字 38 图
预计阅读时长:17分钟
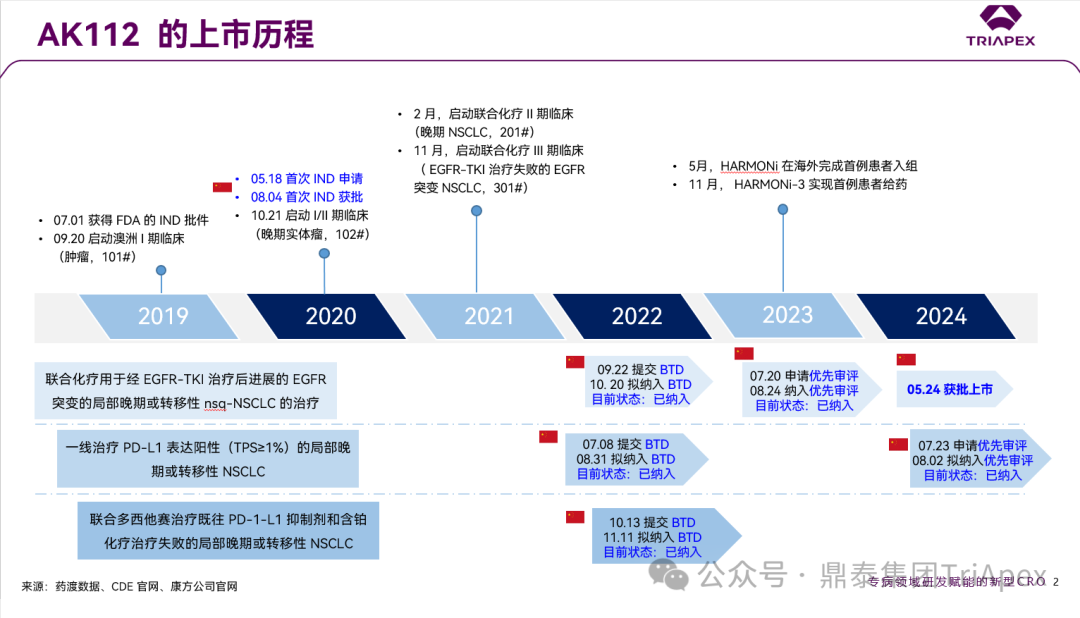
依沃西单抗临床开发历程回顾 通过在临床布局上的精心规划,康方成功实现了多款产品的快速上市,包括如 PD-1 单抗派安普利、PD-1/CTLA-4 双抗卡度尼利、PD-1/VEGF 双抗依沃西。 不可否认,作为一家 Biotech(或许Biopharma更为合适了),康方生物在创新药的研发立项和上市效率方面是叹为观止的,这充分展现了其独到的研发策略,充分尊重新药研发的规律和原则。 安全性和有效性源于分子设计,康方生物的研发策略体现在对药理作用机制和分子特性的深入研究,这为临床概念验证提供了坚实的基础;更为重要的是,其研发策略体现在对临床试验设计的科学性和前瞻性以及商业机会的敏锐洞察上,在此不一一枚举;同时,注重与国际标准接轨,确保临床试验设计符合全球监管机构的要求。 AK112 背景信息,来源:鼎泰团队 依沃西单抗基于早期探索性临床试验的结果,现已启动多项关键性临床试验(包括 MRCT)。 来源:依沃西单抗注射液. 康方生物. 2024 来源:康方生物 2024 H1 年报 关于依沃西单抗的临床开发历程,鼎泰团队进行了深度复盘,在此仅借助一页内容展示其在快速推进产品上市方面的成功经验。希望这一经验能为行业内真正有志于新药研发的企业提供有益的借鉴。 依沃西单抗的上市历程,来源:鼎泰团队 依沃西单抗 2024 年的关键里程碑事件,来源:康方生物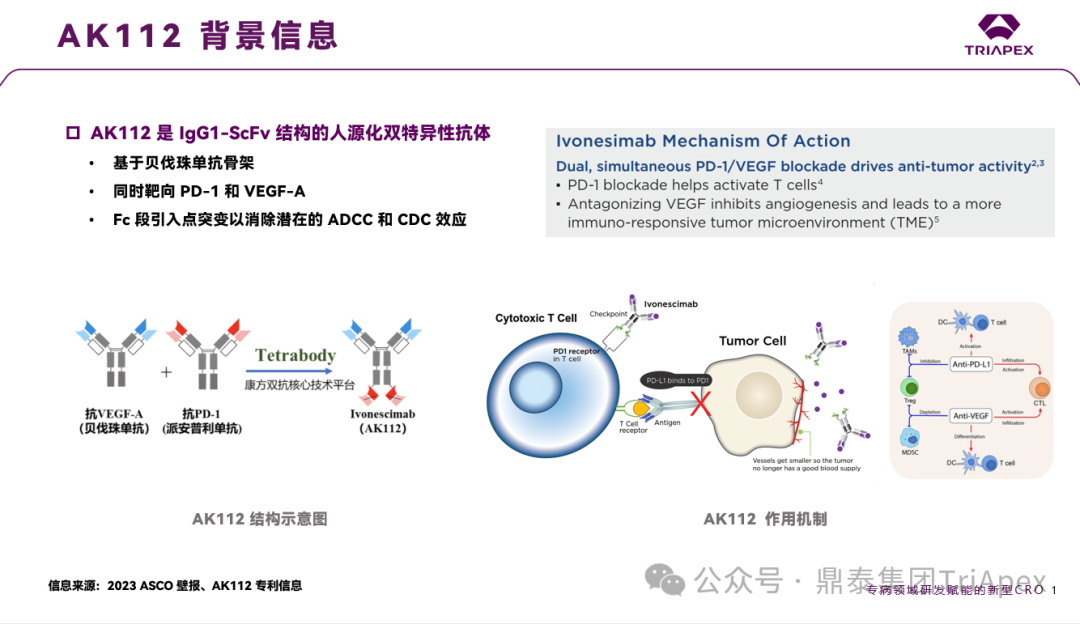


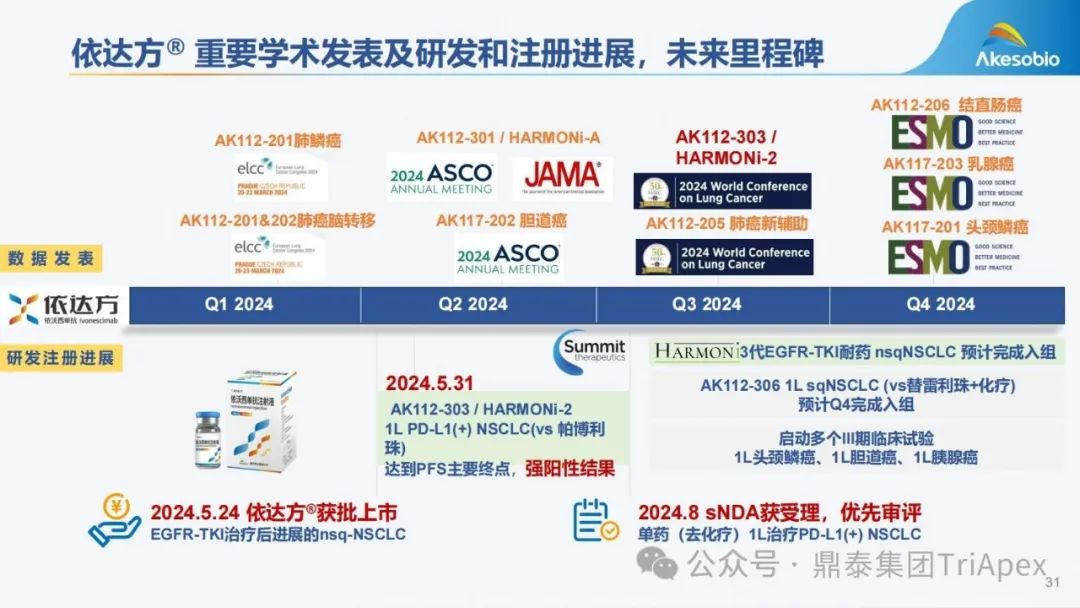
HARMONi-2 期中分析结果与启示 近期正在召开的 2024 年世界肺癌大会(WCLC)上展示了 2 项与依沃西单抗相关的研究: 依沃西单抗单药或联合方案用于围手术期治疗可切除 NSCLC 的 II 期研究(AK112-205) 依沃西单抗单药对比帕博利珠单抗单药一线治疗 PD-L1 表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性 NSCLC 的注册性 III 期临床研究(HARMONi-2/AK112-303) 来源:WCLC website,康方生物website

来源:WCLC website 北京时间 9 月 8 日晚,周彩存教授团队在 2024 WCLC PL02. Presidential Symposium 1 (LIVESTREAMED) Session 正式报告了依沃西单抗头对头对比帕博利珠单抗用于 PD-L1 表达阳性 NSCLC 一线治疗的 III 期临床试验期中分析(Interim Analysis)结果。尽管此前不同媒体渠道和康方生物 2024 H1 报告中已有铺垫,业界对具体结果的重磅程度和背后的临床价值仍然充满期待。 来源:WCLC website

该研究是一项依沃西单抗对比帕博利珠单抗一线治疗 PD-L1 表达阳性(TPS≥1%)的局部晚期或转移性 NSCLC 的随机、对照、多中心III期临床研究(NCT05499390,研究代号 AK112-303 或 HARMONi-2)。HARMONi-2 研究在 clinicaltrial.gov 的首次登记时间为 2002 年 8 月 11 日,计划招募 398 人。主要终点为 PFS,由独立影像评估委员会(IRRC)根据 RECIST v1.1 评估;关键次要终点为 OS;次要终点为 IRRC 评估的 ORR、DOR、DCR、TTR(RECIST v1.1),研究者评估的 PFS、ORR、DOR、DCR、TTR(RECIST v1.1),AE、ADA 和 PD-L1 表达状态。试验设计: 来源:2024 WCLC 患者分层因素包括临床分期、组织学(鳞癌、非鳞癌)、PD-L1 表达水平(PD-L1 TPS≥50% 和 1~49%),从两组的实际入组人数来看,基本上是均衡的。此外,试验中还入组了少量的肝转移和脑转移的患者。 以下列出了本试验的主要的纳入标准: ◆ Inclusion Criteria : Has a histologically or cytologically confirmed diagnosis of NSCLC. 组织学或细胞学证实的,不能行手术完全切除且不能接受根治性同步/序贯放化疗的局部晚期(ⅢB/ⅢC期)或转移性(IV期)NSCLC Has Stage IIIB/C or IV NSCLC (American Joint Committee on Cancer [AJCC]). ≥18 years old (at the time consent is obtained). Be able and willing to provide written informed consent and to comply with all requirements of study participation (including all study procedures). Be able to provide formalin fixed, paraffin-embedded (FFPE) tumor tissue. Has a life expectancy of at least 3 months. Has an Eastern Cooperative Oncology Group (ECOG) performance status of 0 or 1. Has measurable disease based on Response Evaluation Criteria in Solid Tumors (RECIST) 1.1 as determined by the site study team. 无 EGFR 敏感突变或 ALK 基因易位改变 Has no EGFR-sensitive mutations or ALK gene translocations. 入组前中心实验室检测的肿瘤组织 PD-L1 表达阳性Has positive PD-L1 expression in tumor tissue. Has no prior systemic anti-tumor therapy for locally advanced or metastatic NSCLC. Has adequate organ function. Has recovered from the effects of any prior radiotherapy or surgery. All female and male subjects of reproductive potential must agree to use an effective method of contraception, as determined by the Investigator, during and for 120 days after the last dose of study treatment.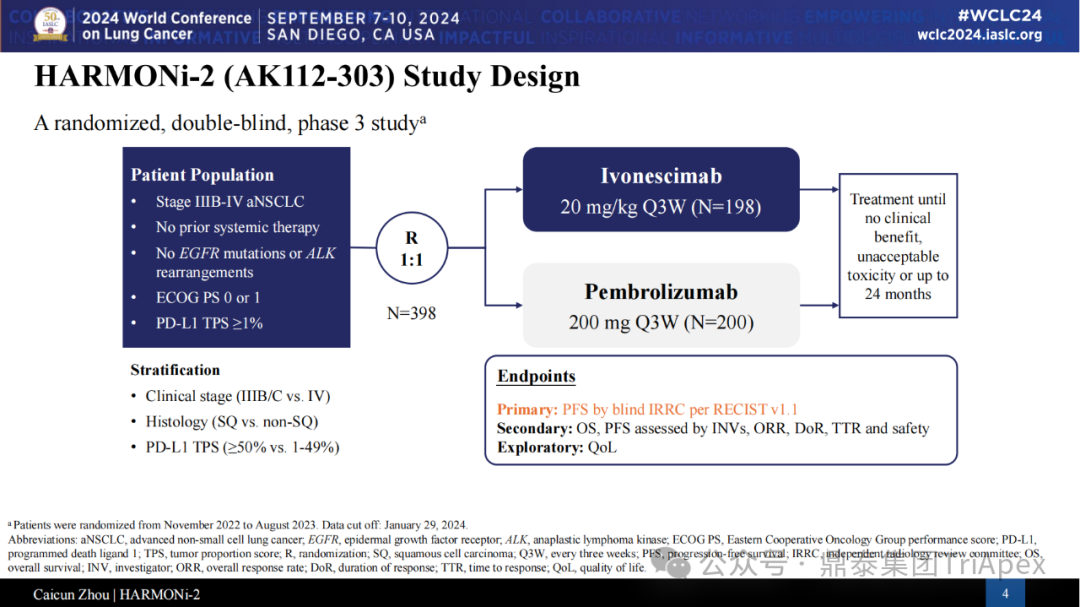
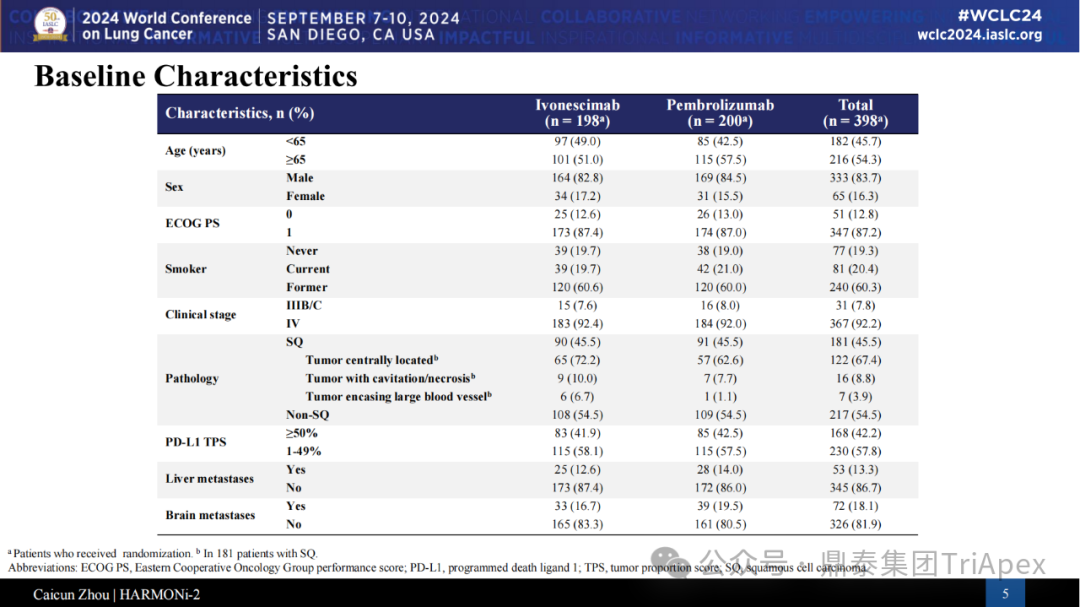
与会前了解的信息类似,本次 WCLC 上发布的是主要终点 PFS 的数据,次要终点 OS 的数据尚未成熟。从依沃西单抗与帕博利珠单抗的中位 PFS 及其 HR 来看,依沃西单抗在 ITT 人群中显著、超预期地达到了预设的统计学终点。 来源:2024 WCLC ■ 主要研究结果简报 ITT mPFS:依沃西相比帕博利珠单抗取得创纪录研究结果,mPFS 11.14个月 vs 5.82个月。 ITT HR:依沃西相比帕博利珠单抗降低疾病进展或死亡风险达49%,PFS HR达 0.51(P<0.0001)。 ITT ORR&DCR:依沃西相比帕博利珠单抗显著提升了患者的 ORR(50.0% vs 38.5%)和 DCR(89.9% vs 70.5%)。 PD-L1 表达亚组:依沃西相比帕博利珠单抗在PD-L1 TPS≥50%人群的 PFS HR 达 0.46,在PD-L1 TPS 1-49% 人群的 PFS HR 达 0.54。 鳞癌/非鳞癌亚组:依沃西相比帕博利珠单抗在鳞状非小细胞肺癌人群的PFS HR达 0.48,在非鳞状非小细胞肺癌人群的PFS HR达 0.54。 难治性亚组:依沃西相比帕博利珠单抗,在肝转移、脑转移等难治性患者人群均具有显著更优的临床获益。 依沃西安全性优异:在 ITT 人群(不同PD-L1表达水平、鳞癌和非鳞癌、各难治性亚组,以及严重高出血风险人群)中,依沃西展现了优异的安全性。 来源:康方生物官网 ■ PD-L1 表达水平亚组分析 此前的临床试验(Keynote-042)结果显示,NSCLC 样本中 PD-L1 表达水平与 PD-1 单抗的疗效正相关,如 TPS≥50% 的患者理论上具有更高的PFS。因此,本研究 PD-L1 的表达水平和各水平亚组在整个研究中的占比将很大程度上影响意向治疗(ITT)人群的PFS和最终的统计学分析结果。在研究中,依沃西单抗组和帕博利珠单抗组 TPS≥50% 亚组占比分别为 41.9% 和 42.5%,TPS 1~49% 亚组占比分别为 58.2 和 57.5%。在两个亚组的人群中,PFS 都取得了显著的延长(下图)。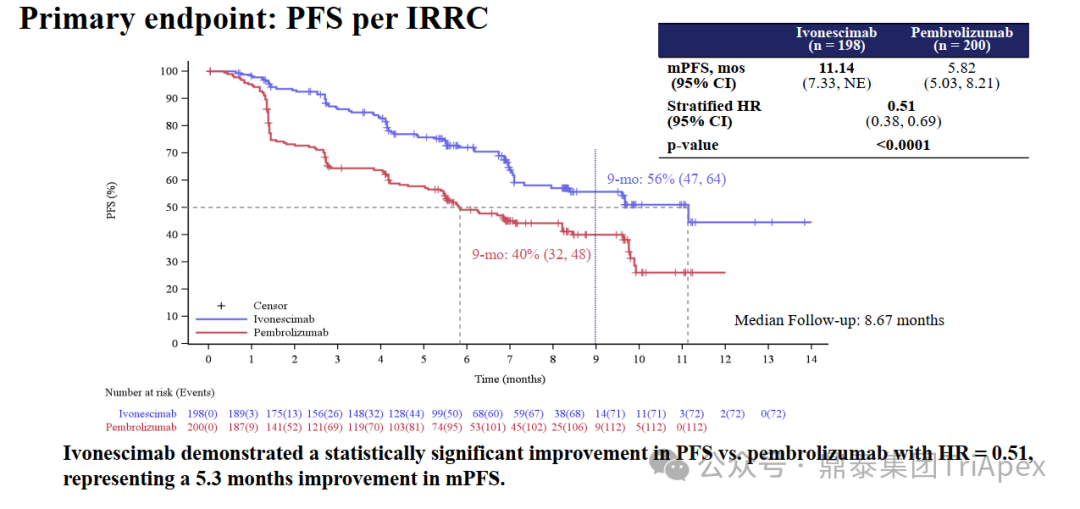
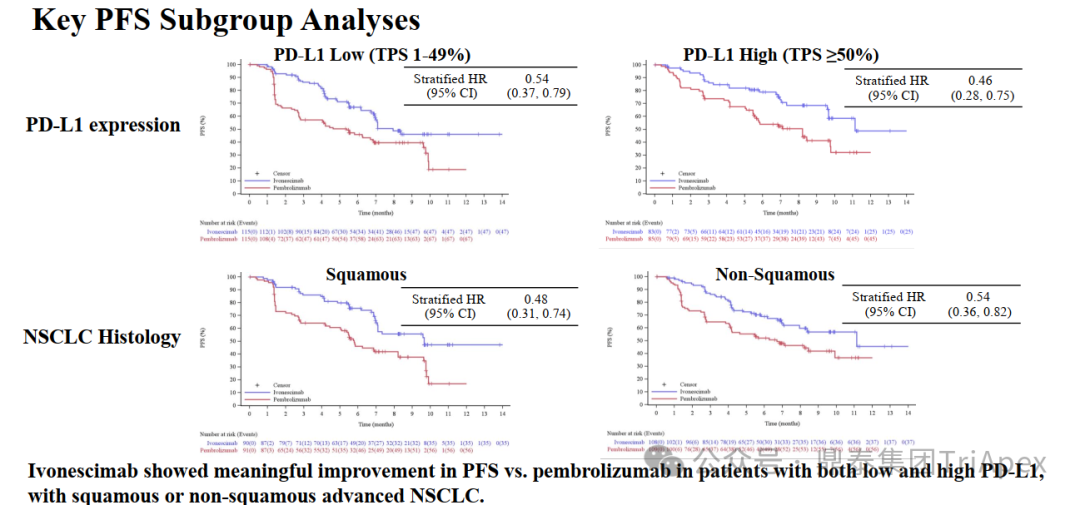
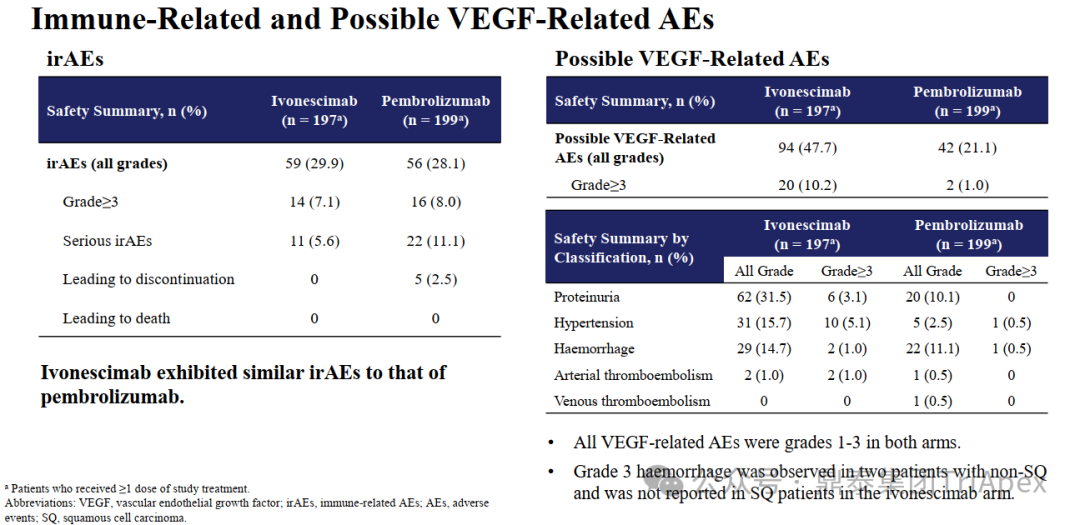
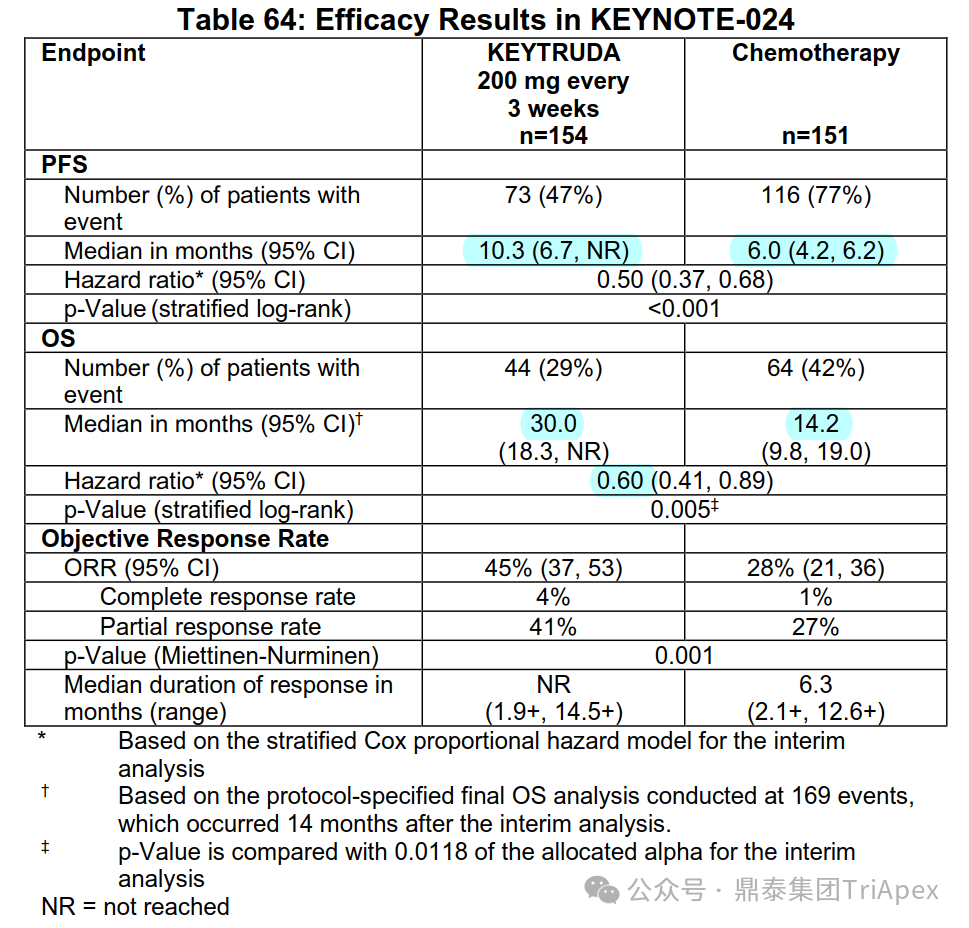
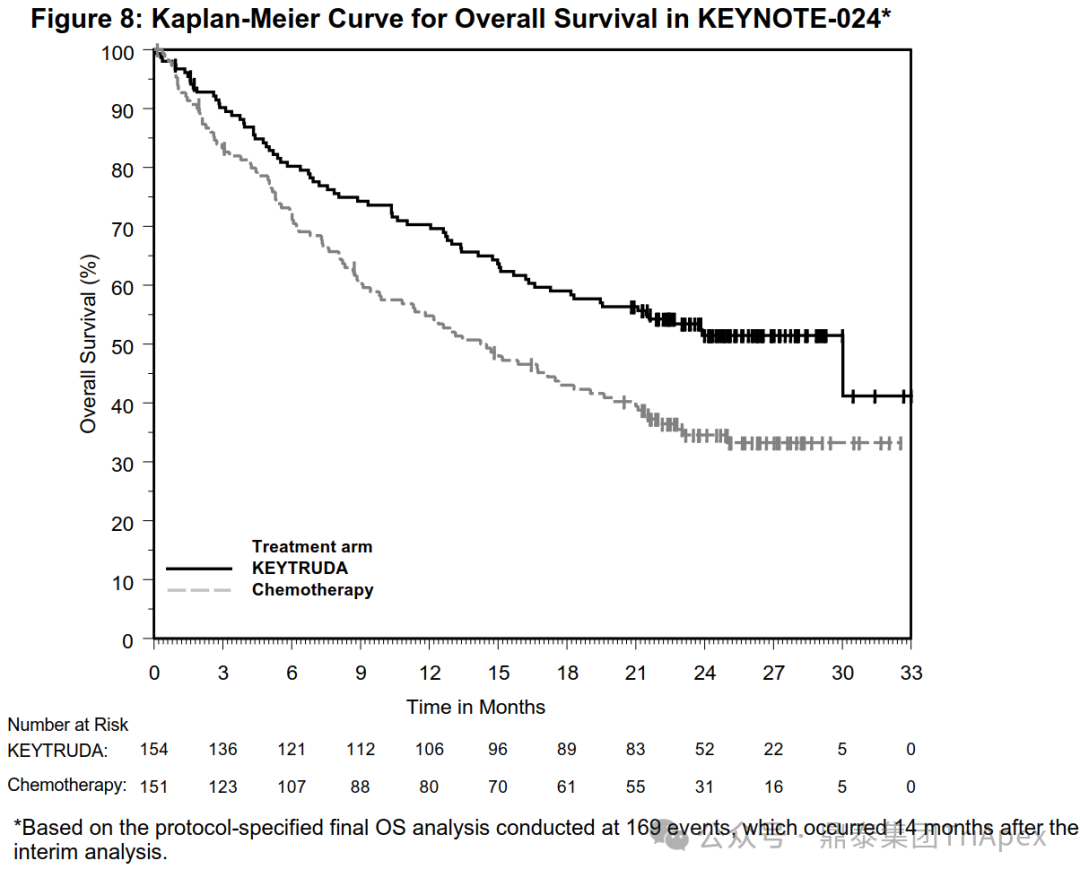
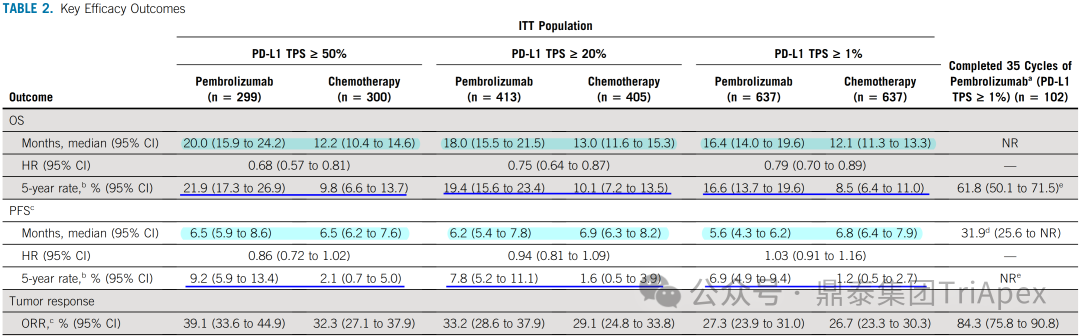
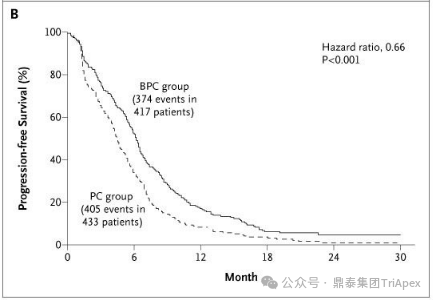
HARMONi-2 试验亚组人群获益情况分析 来源:2024 WCLC ■ 鳞癌患者是否安全且获益 在 Keynote-042 试验中,鳞癌和非鳞癌患者均有显著获益,其中鳞癌患者约占 39%。考虑到临床应用中,鳞癌患者在接受抗血管治疗时容易发生出血,而依沃西单抗同时靶向 PD-1 和 VEGF,因此对于鳞癌亚组的安全性和有效性是值得关注的问题。 在 HARMONi-2 试验中,依沃西单抗组和帕博利珠单抗组鳞癌患者占比分别为 45.5% 和 45.5%。从会议中披露的安全性和有效性数据来看,NSCLC 鳞癌患者的耐受性与非鳞癌患者相当,且仍然是可以从依沃西单抗的治疗中获益的(上图)。这从侧面说明同时靶向 PD-1 和 VEGF 的依沃西单抗具有不同于单纯的抗血管治疗药物贝伐珠单抗的安全性特征,这一结论或许我们可以从普米斯生物的 PD-L1/VEGF 双抗(PM8002)的临床表现中得到进一步的确证,我们共同期待。 HARMONi-2 试验 AE 情况分析(含鳞癌亚组分析) HARMONi-2 试验免疫相关和 VEGF 相关的 AE 情况分析 来源:2024 WCLC ■ PFS 获益能否转化为生存获益 至于 PFS 的延长能否转化为 OS 的显著获益,我们仍然需要拭目以待。 怀着一颗对生命的敬畏之心和祝愿依沃西单抗能够真正成为“国药之光”的善良之心,鼎泰团队回顾了 Keynote-024 和 Keynote-042 的数据,以期在 OS 数据成熟之前能找到足以慰藉的让患者生存期延长的信心和勇气。 Keynote-024 试验(NCT02142738)中(n=305),入组人群为 TPS≥50% 的转移性 NSCLC 患者,主要终点为 BICR 评估的 PFS(RECIST v1.1),次要终点为 BICR 评估的 OS 和 ORR。结果显示,PFS 显著延长(10.3 月 vs 6.0 月;HR=0.50);OS 也显著延长(30.0月 vs 14.2 月;HR=0.60)。 FDA label of Keytruda. Aug 2024 Keynote-042 试验(NCT02220894)中(n=1274),入组人群为 TPS≥1% 的不适合手术的III级或转移性 NSCLC 患者,主要终点为 TPS≥50%、TPS≥20% 和 TPS≥1% 人群的 OS。结果显示,在所有人群和 3 个亚组中,帕博利珠单抗组的 OS 均显著高于化疗组。亚组分析结果显示,在 TPS ≥1% 人群中(即全人群),尽管未取得明显的 FPS 延长(5.6 月 vs 6.8 月),OS 显著延长(16.6 月 vs 8.5 月);在 TPS ≥20%人群中(占比分别为 64.8% 和 63.6%),OS 显著延长(19.4 月 vs 10.1 月),PFS 分别为 6.2 月 vs 6.9 月);在 TPS≥50% 人群中(占比分别为 46.9% 和 47.1%),OS 显著延长(20.0 月 vs 12.2 月),FPS 分别为 6.5 月 vs 6.5 月。 Keynote-042 试验中 PFS 亚组分析 来源:Five-Year Outcomes With Pembrolizumab Versus Chemotherapy as First-Line Therapy in Patients With Non–Small-Cell Lung Cancer and Programmed Death Ligand-1 Tumor Proportion Score ‡ 1% in the KEYNOTE-042 Study. 2023 此外,再往前追溯一下,贝伐珠单抗联合化疗对比化疗用于 NSCLC 一线治疗临床试验(E4599 (NCT00021060))中,PFS 为 6.2 个月。由于年代久远且患者基线状态不同,在此仅供参考。 贝伐珠单抗联合化疗用于 NSCLC 一线治疗的 PFS 来源:Paclitaxel–Carboplatin Alone or with Bevacizumab for Non–Small-Cell Lung Cancer.2006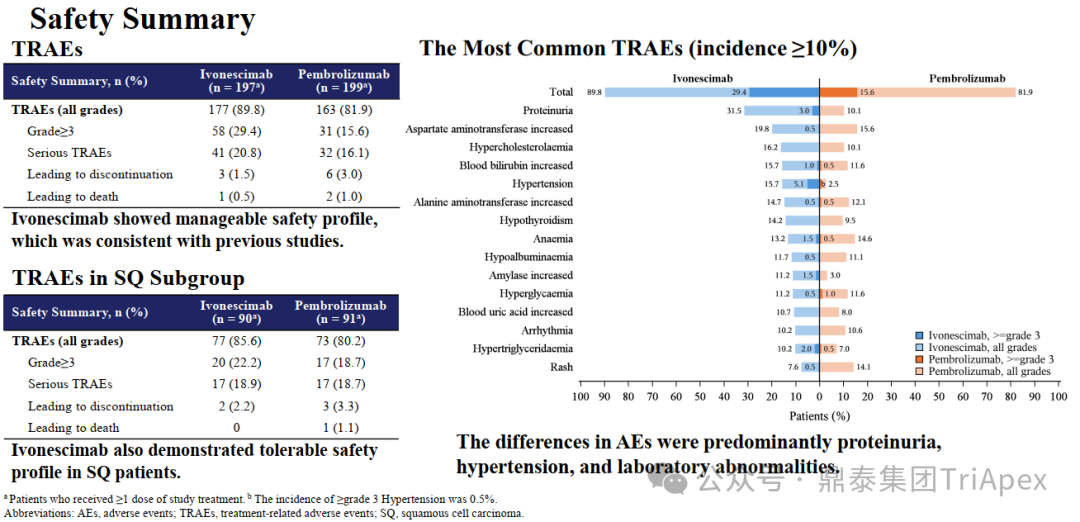
考虑到 HARMONi-2 试验各亚组人群与 Keynote-042 相似,在这样的基线状态下,依沃西单抗治疗组的 PFS 显著延长,是非常振奋人心的结果!至于 PFS 的获益能否转化为患者的长期高质量生存,我们只能静待时间给出的答案。相对于那些日渐缩短的有限的数字,或许信心更能给予人们力量。依沃西单抗 PFS 的获益足以提示患者在“去化疗”方案中给于患者的更高的生活质量、给于患者本人和亲人的更大的生存信心,这或许本身已经是巨大的进步。 值得注意的是,由于近年来治疗实践的巨大改变,如多个免疫治疗(包括联合化疗)后线治疗的获批、已获批或在研 ADC 药物临床试验的应用等,使得本试验中患者疾病进展后的治疗会比较复杂,也会对 OS 数据的读出带来一定的干扰。 ■ 其他亚组分析 其他亚组分类也值得关注,如脑转移状态、疾病状态等。 在 Keynote-042 试验中,入组了少量(70例)脑转移患者。比较欣喜的是,帕博利珠单抗对于这部分患者也表现出较好的 OS 获益(HR=0.64)。HARMONi-A 试验中,依沃西单抗和帕博利珠单抗组分别入组了 33 例(16.7%)和 39 例(19.5%)脑转移患者,据悉也获得了有效性优势。 对于试验组所采用的试剂盒是否为 DAKO 22C3、TPS 的具体定义以及是否需要开发伴随诊断产品等,在报告中没有明确提及,我们会继续跟进。
结语
“我曾经跨过山和大海 也穿过人山人海
我曾经拥有着一切 转眼都飘散如烟
我曾经失落失望失掉所有方向
直到看见平凡才是唯一的答案
我曾经毁了我的一切 只想永远地离开
我曾经堕入无边黑暗 想挣扎无法自拔
我曾经像你像他像那野草野花
绝望着渴望着哭着笑着平凡着
我曾经跨过山和大海 也穿过人山人海
我曾经问遍整个世界 从来没得到答案
我不过像你像他像那野草野花
冥冥中这是我唯一要走的路啊
时间无言 如此这般
明天已在眼前”


































































































































