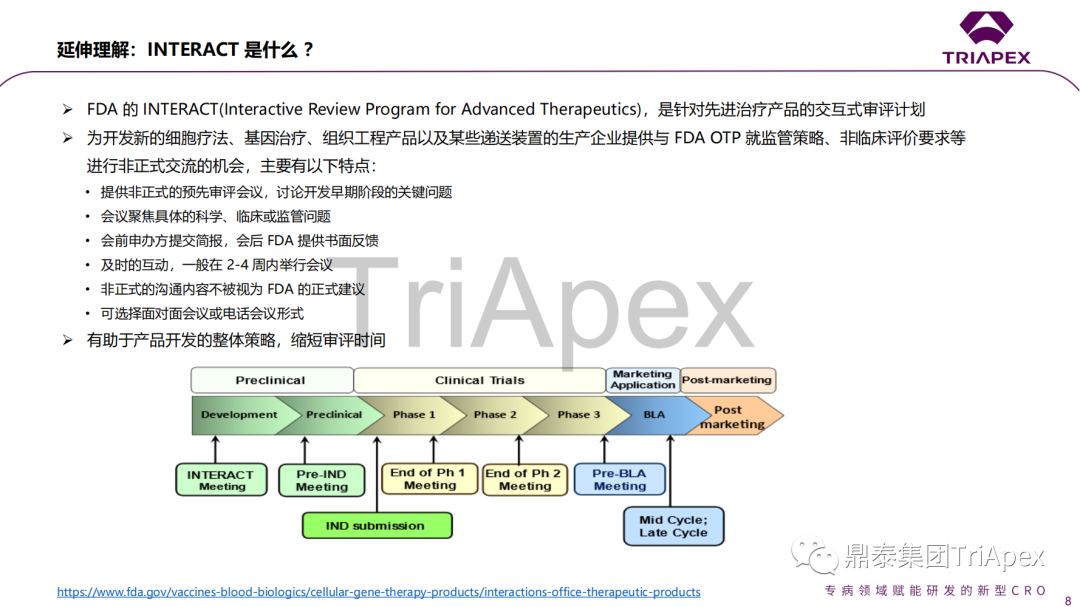
上一期,鼎泰集团就美国食品药品监督管理局(FDA)生物制品评价和研究中心(CBER)的治疗产品办公室(OTP)举行的关于细胞和基因治疗(CGT)产品非临床评价的网络研讨会中的相关问题第一时间进行了线上分享,并收到了很多业界同行的关注和交换意见。由于这些问题代表了目前业内普遍关注的实际研发难点和审评关注点,这些问题及其答复的梳理和解读对于指导国内CGT产品非临床研究将具有重要的参考价值。 鼎泰集团转化科学与药政策略团队已完成对会议中讨论的所有问题和FDA OTP的回复意见的梳理和解读。由于内容较多,接下来将分 4 期进行线上分享。 本期共涉及会前征集的27个问题中的前13个,主要涉及的内容包括: CGT 产品非临床研究的动物种属数量 目标患者特征与动物种属选择 无合适动物种属时的情形 CGT产品非临床研究不用或少用NHP的可能性 支持儿童队列所需的非临床研究 仅 non-GLP 试验是否可支持 FIH 动物模型不适用时, 替代分子或不开展体内试验是否可行 临床递送装置不适用于非临床动物疾病模型时的情形 非临床研究从体内试验转向体外试验的可能性 用于生物分布试验的动物种属 LNP 辅料的生物分布和代谢产物鉴定 细胞治疗产品的生物分布试验必要性 人体干细胞产品的非临床研究 会议中讨论的问题、答复以及鼎泰团队的解读预览(第1期): 接下来,鼎泰集团转化科学与药政策略团队将继续就会议中讨论的剩余问题和FDA OTP的回复意见的梳理和解读进行分享,以便更好地指导机构内当前工作,并为更多的鼎泰客户提供科学、高效、满足监管要求的非临床研究服务。同时,也期待与更多从事CGT产品开发的同行进行积极的交流、探讨、共同提高。