


在寡核苷酸药物的体内旅程中,肝脏与肾脏如同配合精密的"双枢纽"——肝脏主导药物的摄取、生效与分解代谢,而肾脏执掌药物及其代谢产物的滤过与清除。深入理解他们的协同机制,不仅能为提高某些经肝脏递送的药物的疗效提供思路,更能为相关不良反应的解读和毒性溯源提供简介。作为国内寡核苷酸药物研发的先行者,鼎泰集团已累计完成 70 余项寡核苷酸药物的各类研究。在长期实践中,我们与合作伙伴反复探讨的一个核心问题:如何通过肝/肾组织药物浓度监测,更精准地提示药效与安全性? 本文将以 GalNAc-siRNA 为例,从机制解析到案例实践,带您探寻这一问题的科学答案。
全文共:5330 字 13 图
预计阅读时长:15 分钟
得益于独特的作用机制和特殊的递送系统,寡核苷酸药物(ONTs)开始从聚焦于罕见病领域向代谢性疾病等领域扩展,并在药物研发中占据重要地位。截至目前,已上市的 siRNA 共 7 款,其中 GalNAc-siRNA 有 6 款,分别为 Givosiran、Inclisiran、Lumasiran、Vutrisiran 和 Nedosiran 以及 Fitusiran(2025 年 3 月 28 日最新 FDA 获批上市)。往期的文章中,鼎泰团队已对上述其中 5 款产品(另一款为 LNP 递送的 siRNA,Patisiran)的临床开发路径、上市历程和非临床支持临床转化的关键环节等进行了较为全面的复盘和分析,详见下方链接:
关键词:ATTR-PN;TTR;首个 LNP-siRNA
关键词:AHP;ALAS1;首个 GalNAc-siRNA
关键词:PH1;HAO1;GalNAc-siRNA
关键词:血脂异常;PCSK9;GalNAc-siRNA
关键词:ATTR-PN;TTR ;GalNAc-siRNA
关键词:PH1;LDH;GalNAc-siRNA
目前,国际上尚未形成统一的用于指导寡核苷酸药物研发和评价的指导原则。仅日本药品和医疗器械管理局(PMDA)于 2020 年 3 月发布了《寡核苷酸药物的临床前安全性评价指导原则》,以及 FDA 于 2024 年 11 月发布的《基于寡核苷酸的疗法的非临床安全性评价》指南草案,概述了 FDA 对于药理学和药代动力学特征以及开展不同毒性研究的期望。鼎泰团队于 2024 年 12 月在《中国新药杂志》发表了《寡核苷酸药物非临床安全性评价的一般考虑及案例分析》一文,对 ONTs 非临床安全性评价的策略、研究内容和关注点进行了概述。(点击查看)
近年来,以 GalNAc-siRNA 为代表的寡核苷酸药物日新月异,从早期筛选到非临床研发和临床转化,其复杂性和对于科学研究的诉求远超现有指导原则所涵盖的范围。研究思路和评价手段只有与产品开发需求和产品特征相契合,才是指导创新寡核苷酸药物研发的真章。在长期实践中,我们与合作伙伴反复探讨的一个核心问题之一:如何通过肝/肾组织药物浓度监测,更精准地提示药效与安全性?本文将基于既往对 70 余项 siRNA 药物研发的实践经验,以及对相关技术指南、行业白皮书的深度理解,从机制解析到实际案例展开探讨,旨在为以 GalNAc-siRNA 为代表的寡核苷酸药物肝、肾组织药物浓度的设计提供参考思路。
影响寡核苷酸药物体内行为的物质基础
siRNA 作为双链 RNA 分子,通常通过 RNA 干扰途径介导靶 mRNA 的切割和降解。由于 siRNA 是高极性分子,不能通过被动扩散有效地穿过细胞膜,且极易被体内核酸酶降解。因此,需要借助化学修饰和/或递送系统促进细胞内递送。
siRNA 常见的化学修饰有硫代磷酸酯(PS)、2'O- 甲基(2'-OMe)和 2'- 脱氧 -2'-氟(2'-F)等。例如,Alnylam 的 ESC siRNA 在核糖的 2' 位置被 2'-OMe 和 2'-F 完全修饰,增强核酸酶稳定性,降低免疫刺激特性,并增加与互补 RNA 的结合亲和力。
此外,在 siRNA 药物的研发中,为了满足肝外递送场景的需求,研究人员也在不断探索新的递送技术。例如,Arrowhead 公司基于其 TRiMTM 平台开发了一系列创新产品,通过局部注射(如鞘内给药)和皮下给药的方式实现精准靶向递送,并针对多个创新靶点展开了研究(点击详见往期文章)。
尽管修饰后的 siRNA 性质稳定,递送至肝脏后仍不能免除核酸酶的降解作用,在核酸外切酶的作用下从 RNA 链的 3‘ 端或 5’ 端逐步水解,产生 N-1、N-2 等代谢产物,通常情况下这些代谢产物仍具有一定的药理活性。此外,如何通过新型递送系统有效实现靶组织的精准递送,并降低在非靶组织中的暴露水平,仍是 siRNA 药物开发早期筛选与后期临床阶段面临的重要课题。这些药物在体内的行为特征构成了影响其安全性和有效性的重要物质基础。
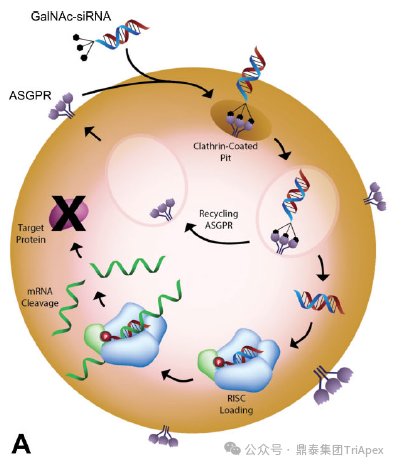
图1. GalNAc-siRNA 体内作用机制示意图
siRNA 药物肝、肾组织浓度检测策略
1
指导后期研发角度的设计
对于 GalNAc-siRNA,由于可高效地肝组织递送,造成肝组织药物暴露量过高,引起相关毒性反应;其他血流丰富的组织(如肾脏)也是主要分布的场所。此外,组织中的高暴露常可引起组织细胞空泡化、嗜碱性颗粒、单细胞坏死等变化。因此,GalNAc-siRNA 肝、肾组织中的药物浓度检测非常重要。研究表明,GalNAc-siRNA 药物在血浆中由于结构修饰通常较稳定,在组织中的代谢特征与血浆中不一致且半衰期远远长于血浆。
基于以上分析,目前鼎泰团队参与的 GalNAc-siRNA 研究中,绝大多数采取在预试验终点时采集肝、肾组织样本,并进行组织药物浓度检测,而在后续 GLP 试验中采集组织样本备测(根据预试验结果决定是否检测)的策略。这样设计有以下方面的考虑:
在出现高暴露器官(肝、肾)非预期毒性时,可借由肝、肾组织的药物暴露数据加以解释;
早于正式试验的组织浓度检测,可以提早获得组织/血液药物浓度比值(肝血比),进而了解 GalNAc-siRNA 候选产品的组织递送效率;
提前探索体内试验中,组织中原形药和代谢产物的关系,为后续正式试验提供参考;
在预试验中检测,相较于 GLP 试验中的大样本,可一定程度上降低成本。
GalNAc-siRNA 体内研究显示,在大鼠、食蟹猴及人血浆中,AS 链、SS 链几乎以 1:1 存在,测定的单链 AS 链浓度水平能够反映出完整的双链浓度水平。因此,对于肝、肾药物浓度检测指标,为评估药物的毒代动力学和组织分布特征,建议在相关研究中设置 AS 链的检测(如有必要,也可增加 SS 链检测)。
2
代谢产物安全性评价角度的思考
与常规小分子化药类似,还需关注对高比例代谢产物和/或活性代谢产物的考察。
根据相关指导原则,如果人体血浆中代谢产物的稳态暴露量 ≥10% 总物质且显著高于非临床,则需要对其安全性进行评估。提前在非临床试验中进行检测则可以更好地提示代谢产物的评价策略。如果代谢产物有活性,不管其暴露水平如何,进行肝脏中浓度的检测,有助于提示其产生疗效的物质基础以及疗效的维持情况。
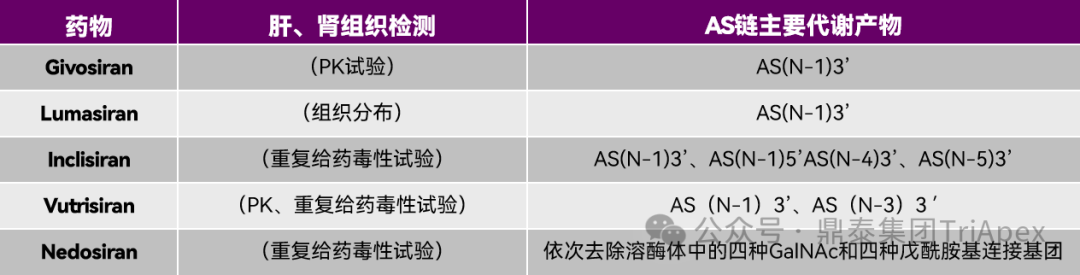
一个经典的关于 GalNAc-siRNA 产品的案例是 Givosiran,其临床研究显示活性代谢产物 AS(N-1)3’ 在人血浆中的占比达到了 33%。虽然正式的 GLP 毒理试验未检测该代谢产物,但其他非临床研究结果显示,Givosiran 在各种属肝细胞代谢研究中与相关种属体内代谢一致,且根据其在大鼠和猴PK试验结果(主要代谢产物为 AS(N-1)3’,占比分别为 17% 和 42%)以及 13 周重复给药毒代结果推测,其 NOAEL 剂量下代谢产物暴露量远高于临床有效剂量下代谢产物的暴露量,因此无需开展额外的代谢产物研究。
表1. 非临床和临床试验中 Givosiran 主要代谢产物暴露情况汇总

是否检测 AS(N-1)3’、 AS(N-2)3’ 以及其他代谢产物,除了基于对活性及其比例的评估外,最根本的出发点在于提前评价代谢产物的暴露量,并借此评估是否已经对代谢产物进行了充分的安全性评价。其法规和监管背景是代谢产物安全性评价指导原则,在支持 IND 的试验中进行研究有助于提前应对将来代谢产物安全性评价的相关问题。
3
鼎泰团队的研究思路
基于以上分析,鼎泰团队建议在至少 1 项非临床试验中进行体内代谢产物的检测,尤其是在至少一项非临床试验中进行相关评估,以应对后续可能的安全性评价要求。具体而言,如果能够获得 AS(N-1)3’ 的标准品,我们建议可以在临床前阶段即开展针对性测试。这样可以避免在临床阶段样本分析时,若发现 AS(N-1)3’ 作为潜在主要代谢产物需要额外启动新试验进行考察的情况。通常情况下,对活性代谢产物进行考察时,关注至 AS(N-1)3’ 即可基本满足要求,当然还应结合具体产品的结构和代谢特征进行优化和调整。

图2. 鼎泰团队关于 GalNAc-siRNA 肝、肾组织药物浓度检测的设计思路
除了 GalNAc-siRNA 的上述思路外,笔者注意到,现在有越来越多研发企业正在探索肝外递送的 siRNA 药物。对于这一类产品来讲,尽管不是以肝脏和肾脏为主要递送靶器官,但是由于他们特殊的生理功能,在早期试验中进行必要的探索对于指导后期开发仍然是有帮助的。下期,我们也将针对另一类寡核苷酸药物,即反义寡核苷酸(ASO),引起的肾脏毒性的相关机制进行解析,并提出风险管控措施。
已上市产品及相关项目结果汇总
基于 GalNAc-siRNA 的作用机制和结构特征,在没有药理学相关不良反应的情况下,由于该类产品的类效应,临床开发的 GalNAc-siRNA 显示出相对一致的非临床安全性特征。已上市 GalNAc-siRNA 产品的非临床研究毒性发现显示,其在非临床研究中常见注射部位反应、肝脏和肾脏嗜碱性颗粒聚集和空泡化等毒性发现,并可见药理学相关指标的改变。
研究表明,嗜碱性颗粒聚集是寡核苷酸被递送到高暴露器官后,分布到具有吞噬活性的细胞(如肝枯否细胞和肾脏近曲小管上皮细胞)中,经苏木精染色后在显微镜下的表现;各种大小的空泡与嗜碱性颗粒聚集通常发生在胞浆的同一区域,推测空泡的形成与溶酶体中局部高浓度的寡核苷酸引起的渗透不平衡所导致的膜结合的溶质聚集物膨胀有关。临床试验中常见的不良反应包括注射部位反应、输液相关反应、肝损伤和肾脏毒性等。通过比较这些非临床毒性表现和临床常见不良反应发现,非临床研究较好地预测了 GalNAc-siRNA 出现的临床不良反应,并且他们都与肝、肾组织息息相关,体现了肝、肾组织药物浓度检测的必要性。
表2. 已上市 GalNAc-siRNA 非临床毒性表现和临床常见不良反应汇总

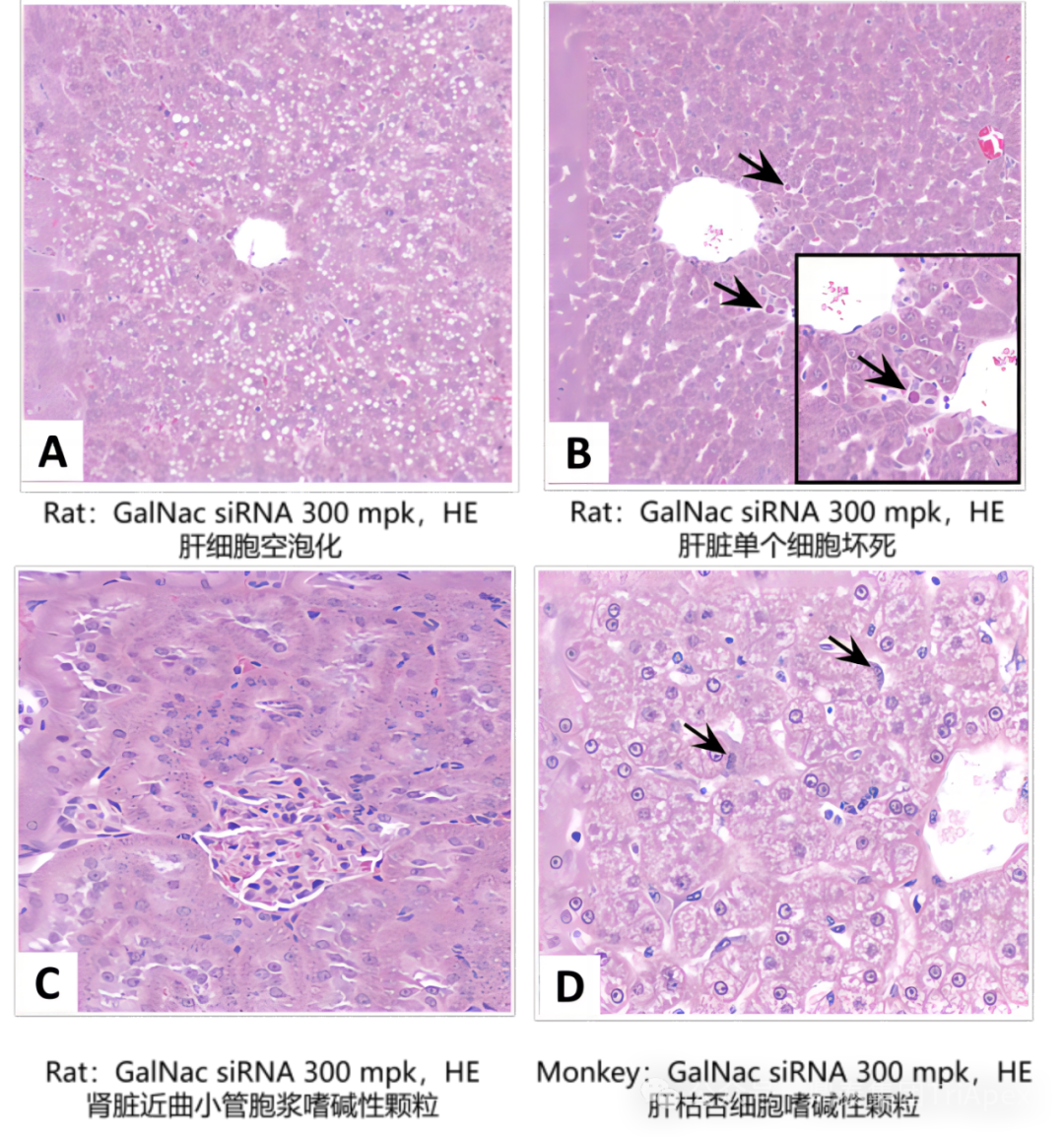
图3. GalNAc-siRNA 相关肝、肾组织病理学示例图
此外,已上市 GalNAc-siRNA 产品的检测指标和代谢产物汇总结果显示,所有的产品均在非临床研究中进行了肝、肾组织药物浓度检测。结果表明,组织中的药物暴露量基本高于血浆,且可定量时间远远长于血浆;AS 链主要代谢产物为 AS(N-1)3’,不同产品有细微差异。
表3. 已上市 GalNAc-siRNA 检测指标和代谢产物汇总
截至目前,鼎泰团队已助力国内外的多家新药研发企业开展了 70 余项 siRNA 项目的非临床研究。已进行的相关研究显示,GalNAc-siRNA 药物重复给药后,在恢复期末(约 8 W)的肝、肾组织中,也可检测到药物浓度,且显著高于血浆中药物浓度,说明药物在组织中的半衰期相较血液中长,这和已有的研究结果一致。此外,通过整理相关专题的研究结果发现,通常猴的肝组织药物检测浓度要大于肾组织,这可能是 GalNAc 特殊递送系统及肾脏作为主要药物清除组织导致;部分研究的结果显示,大鼠肝组织药物浓度检测经常出现小于肾组织的情况,推测是动物种属特异性造成。以上这些药物暴露结果可以和组织病理学结果相对应。目前对于肝、肾组织中药物暴露高低的确切原因尚无定论,是否和 GalNAc-siRNA 药物的序列、化学修饰以及动物种属特异性有关有待进一步研究。
在今年第64届美国毒理学年会上,我们对 GalNAc-siRNA 药物肝肾组织药物浓度检测的考虑也进行了分享,详见海报(进入鼎泰官网查看详情https://zh.tri-apex.com/):

结语
综上,针对 GalNAc-siRNA 药物,建议在非临床研究的预试验中进行肝、肾组织浓度的检测(包括代谢产物),为毒性结果的解释和指导后续试验设计提供参考,同时也有助于对代谢产物评价策略的制定提供指导。对于肝外递送 siRNA 药物,也建议结合产品特点和风险关注点在早期试验中进行必要的探索以指导后期开发。具体到试验设计和结果评价,尚不能一概而论,需要基于既往经验进行科学评价与决策。
供稿:毒理Ⅰ部
参考资料:


































































































































