



关于 IVB103 注射液 据因诺惟康新闻稿介绍,IVB103 注射液是在其自主研发的新型载体基础上开发的一款可玻璃体内给药的治疗新生血管性年龄相关性黄斑变性(nAMD)的药物。临床前数据显示 IVB103 优于国际在研的同类先进产品,具有“best in class”的潜力。在 Information Request 中,FDA 对 IVB103 的 CMC 仅有一个问题,Non-clinical 无问题,显示出因诺惟康自主研发的载体具有良好的安全性和成药性,是以提前收到 FDA 的 IND许可。同时,在国内的 IND 申请也已被中国药品审评中心(CDE)正式受理。
鼎泰集团助力 IVB103 等眼科药物的非临床研究 鼎泰团队凭借专业的技术水平和丰富的眼科项目评价经验,合规、高质、高效的地完成了 IVB103 项目的非临床药效学、药代动力学和安全性评价(包括一般毒理学试验、局部毒性试验、免疫原性和免疫毒性试验、安全药理学试验等)研究,并且提供了 SEND 数据转换和 FDA 注册申报资料撰写及咨询服务,快速助力该产品的中美 IND 申报,大大加速 IVB103 的药物开发进程。 鼎泰团队 6 个月高效助力 IVB103 注射液获批 FDA IND IVB103项目启动 2023.12.26日正式立项 IVB103非临床 药效学研究 4.5个月完成IVB103食蟹猴药效评价试验 IVB103药代动力学 及安全性评价研究 6个月完成SD大鼠和食蟹猴毒性试验,包括伴随生物分布和安全药理试验 SEND数据转换 2024.06.21完成SEND格式标准转换 IVB103注册申报 资料交付 2024.06.24,完成中英双版非临床申报资料撰写 因诺惟康&鼎泰集团 深度合作 6个月完成IVB103项目非临床研究,高效助力其FDA IND申报
目前,鼎泰团队已累积完成多项眼科药物的非临床及临床研究服务,包括年龄相关性黄斑变性、脉络膜新生血管、糖尿病视网膜病变、青光眼、白内障、翼状胬肉、干眼症等多个眼部适应症,高效助力合作伙伴为眼科疾病患者开发更多的治疗选择。 鼎泰集团部分眼科项目评价经验:
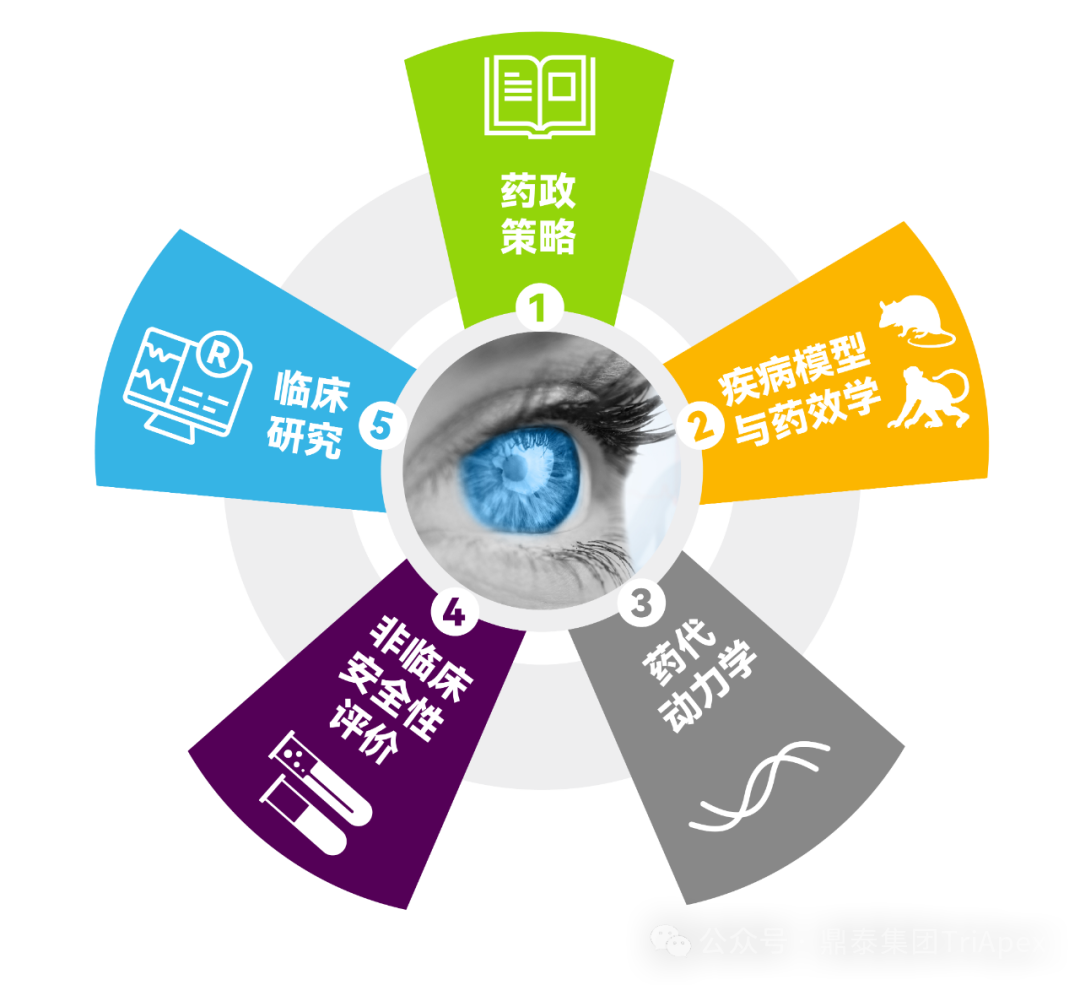
鼎泰集团眼科一体化服务平台 在眼科药物或器械评价领域,鼎泰集团拥有从非临床到临床的一体化眼科研发赋能平台。建立了多种大/小动物疾病模型,配备有行业顶尖的检查、检测分析设备,搭建了深耕眼科数十年的核心科学家团队,积累了基因治疗类、抗体类、小分子类等多种眼科药物的非临床和临床评价经验。 眼科领域一体化研发赋能平台 多种属综合性眼科临床检查能力 眼科疾病领域一体化研发赋能平台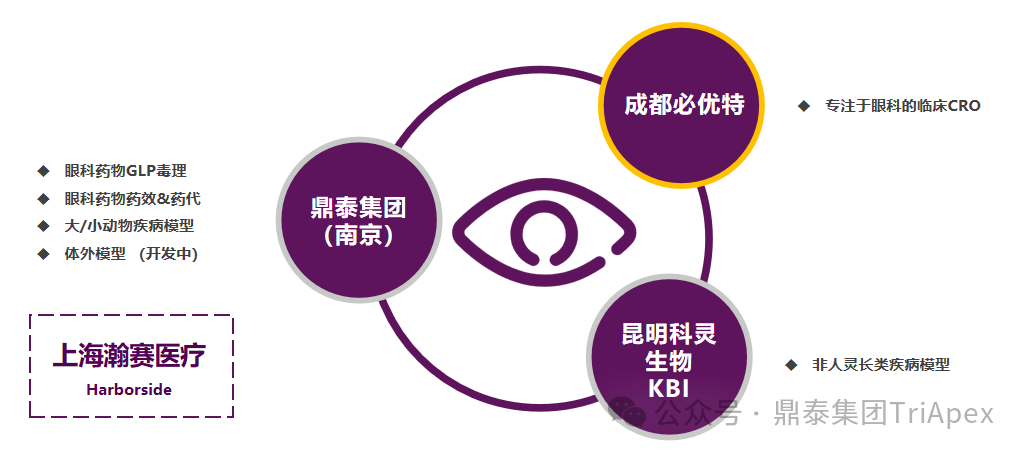

关于因诺惟康


















































































