


过去,药物在进入人体临床试验前,必须进行动物试验以评估其安全性。然而,数据显示,开发新药通常需要 10 到 15 年的时间和巨额资金,且动物试验并未完全可靠地预测人体不良反应。因此,科学界逐渐认识到新的非动物性替代方法(New Alternative Methods, NAMs),如体外试验、微生理系统(Microphysiological Systems,MPS)、器官芯片和计算机建模等,可能具有更高的转化价值。
2022 年 2 月 23 日,FDA 批准阿齐瑞格(azeliragon)直接采用基于器官芯片的数据进入II期临床试验,成为第一个完全基于器官芯片数据获得 FDA IND 批准的药物。
2022 年 12 月 23 日,美国众议院通过了具有里程碑意义的“FDA 现代化法案 2.0(FDA Modernization Act 2.0)”。这是对自 1938 年以来 FDA 药物审批程序的重大改革,该法案最重要的目标就是取消在药物开发过程中强制性开展动物试验的要求。该法案承诺显著减少实验室中对犬、非人灵长类动物及其他动物的使用,标志着对动物试验依赖的减弱。这一变化反映了对动物试验伦理的关注以及对新药开发效率的渴望。FDA 现代化法案 2.0 允许在适当情况下选择使用这些替代方法进行临床前试验,标志着 FDA 开始接受非动物性替代试验方法在药物研发中的应用。这一里程碑式的法案不仅推动了医学研究的进步,也为未来药物开发提供了更灵活和高效的工具。此外,美国环保署(EPA)也在积极探索 NAMs 在监管中的应用,强调现有法规支持使用高科学质量的非动物性试验数据,从而促进科学创新。
根据 FDA 现代化法案 2.0,新型非动物性试验方法被纳入药物批准流程。这些方法包括:
体外试验(In Vitro Testing):利用细胞或组织样本进行试验,以评估药物的活性和安全性。
微生理系统(MPS):使用3D人类细胞模型,模拟人体器官功能,以获得更为准确的药物反应数据。
器官芯片(Organ-on-Chip, OOC):通过微流体技术重建器官功能,更好地模拟药物在人体内的行为和作用。
计算机建模(In Silico Modeling):使用计算机模拟药物的生物学行为,以预测其有效性和安全性。
这些新方法不仅能提高药物开发效率,还能降低对动物试验的依赖,符合现代科学和伦理要求。同时,彰显了科学技术的迅速进步以及对更人道研究方法的需求,为 NAMs 的发展创造了良好的政策环境。
全文共:5451 字 32 图
预计阅读时长:14分钟
FDA NAM 专家会议
FDA Advisory Committee Meeting
2024 年 10 月 7 日, FDA 科学委员会(Advisory committees)召开了一次网络会议,该会议旨在提供独立的专家建议,帮助 FDA 基于科学数据做出决策。会议议程包括来自新替代方法小组(New Alternative Methods subcommittee)的最新进展。会议通过在线视频会议平台进行,并发布了主题报告《Potential Approaches to Drive Future Integration of New Alternative Methods for Regulatory Decision-Making》。


该报告强调了当前技术局限性,主要探讨了未来如何更好地整合 NAMs 以支持监管决策,特别是在减少对动物试验的依赖方面。报告首先介绍了 NAMs 的概念及其在评估药物、食品、化妆品等对人体风险方面的潜力。NAMs 包括体外试验(in vitro tests)、计算机模拟模型(in silico computational models)、生物标志物(biomarkers)和改良的体内试验(modified in vivo assays)等多种技术和方法。此外,报告指出 NAMs 目前还不能完全取代动物试验,但它们可以作为传统方法的有效补充。

推荐建议和科学性考虑
Recommendations and Rationale
为了推动 NAMs 的应用,报告提出了 6 条建议:

1. 建立 NAMs 中心办公室(central NAMs office)
提供全局战略,协调和推动 NAMs 的有效和高效的优先级排序和实施,确保跨部门有效沟通与合作。


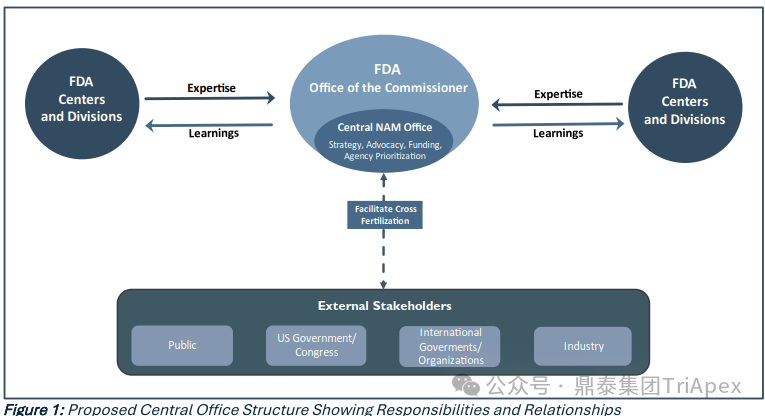
2. 确定有效的评价指标(effective metrics)以衡量 FDA 对 NAMs 持续投资的影响


确定能够有效展示 FDA 对 NAMs 持续投资影响的评价指标。这些指标应便于内部和外部利益相关者定期审查,以提供学习和项目调整的机会。创建中心办公室,以确保采用信息丰富的评价指标支持未来的研发和评估决策。此外,通过增强透明度,帮助技术与研究利益相关者更好地了解哪些试验方法是可接受的,并促进共识。
3. 为 NAMs 制定统一的资格认定框架(framework for qualifications)


创建统一的 FDA 资格认定框架,以促进 NAMs 的使用。开展灵活且统一的单一验证/资格认定(V/Q)模型(如“checklist”),以满足各个 FDA 部门的需求。该框架应遵循FAIR数据原则:可查找性(Findability)、可获取性(Accessibility)、互操作性(Interoperability)和可重用性(Reusability)。在过渡阶段,邀请正在进行资格认定的项目加入新的验证/资格认定方法。
4. 建立透明且科学严谨的审查流程,用于审查依靠 NAMs 来证明有效性和/或安全性的注册申请


确保 FDA 审评员能够充分理解并有效利用 NAMs 数据。进行严格的审评员专业培训和指导,使其能够适度考虑依赖 NAMs 的监管申请。建立最佳实践和持续学习机制,确保审评员理解 NAMs 的潜在机会及其对未来新药研发的影响。对审评员与相关研究人员进行支持和培训,使其能解读和评估 NAMs 数据。同时,创建内部数据库,鼓励一致的数据格式,以便于搜索和分析。
5. 识别并发展有助于监管决策的高影响力的关键项目,以全面执行并帮助监管决策


确定并投资那些具有高影响力的 NAMs 方法,以辅助监管决策。建议基于 FDA 内部经验制定优先事项,例如 PBPK 模型。在不同应用领域中,识别最有可能成功并产生影响的监管情境。从选定的应用案例中学习,推广 NAMs 在多个领域的应用。
6. 编制一个可供 FDA 所有部门使用的中央 NAMs 数据库(NAMs database)


FDA 已认识到修订强制性动物试验的必要性,并引入 NAMs 作为评估产品安全性和有效性的替代方法。该建议旨在解决 FDA 如何确保对替代方法数据的信心以及如何促进这些新方法的采用的问题。FDA 将评估新兴 NAMs 并开发相应的试验方法和方案,将其纳入相应产品的注册申请中。建议建立并维护一个包含计算性和实验性 NAMs 的数据库,这些方法已通过同行评审并被其他美国及国际监管机构采纳。数据库将包括来自 FDA 内部和外部的研究成果,成为审查新产品的重要工具。数据库应整合来自其他政府机构(如 NCATS 和 EPA)的 NAMs 数据,并探索所有 FDA 数据以理解历史特征。
当前 FDA 关于决策中动物使用的规定:NAMs 的机会
Current FDA Regulations Requiring Animals for Decision-Making: Opportunities for NAMs

目前已有许多 FDA 和全球指南规定了 FDA 监管框架下相关产品的上市批准路径。如相关法规和指南所述,当前的监管框架允许并鼓励使用 NAMs 来替代动物试验。
在单个产品决策中,替代方法通常为提交材料提供“证据权重”,作为其他补充信息的一部分。然而,通过跨部门的经验分享和对资料的深入审查,FDA 可以识别出优先考虑最具影响力的方法,以通过开展经过验证的 NAMs 来减少动物使用。由于某些 NAMs 需要在跨器官复杂系统中进行测试,因此可能无法迅速取代动物试验。FDA 将支持那些基于科学、能够产生科学有效数据以满足监管需求的替代方法。
FDA 并不是唯一推崇 NAMs 的机构,国际机构及其他部门和政府机构(如美国环保署 EPA)也在使用 NAMs 方法。通过科学界和合作伙伴关系,学习和进步可以惠及多个利益相关者。FDA 将继续利用现有的预测和验证系统,同时各产品中心继续合作,并发展其监管批准决策所需的科学背景。
以下是一些已经在 FDA 某些中心可用的新型和补充方法示例:
系统生物学(评估细胞和组织反应的多个方面以研究整个生物体)
工程化组织(利用支架和细胞形成生物活性组织)
人工智能(使用计算机模拟方法)
替代生物体(如斑马鱼和秀丽隐杆线虫)
MPS,包括器官芯片
2024 年 9 月 24 日,FDA CDER 已接受新药创新科学和技术方法 (Innovative Science and Technology Approaches for New Drugs,STAND) 试点计划的第一份意向书 (LOI),该计划旨在通过研究器官芯片技术以研究某些候选药物的药物性肝损伤(DILI)。

FDA 还接受减少试验方案中动物数量的方法,并支持如 ICH S6 要求仅测试相关种属、对生殖毒性(ICH S5)和致癌性测试(ICH S2)的豁免选项,以及对肿瘤学适应症取消慢性毒性研究要求(ICH S9)。此外,FDA 还探索了使用“虚拟对照组”来支持减少动物使用的选项。
后记
The Future
报告还概述了 FDA 现有的 3R 框架和 NAMs 原则的现状,并列举了多个 FDA 为推进替代方法所做的努力。
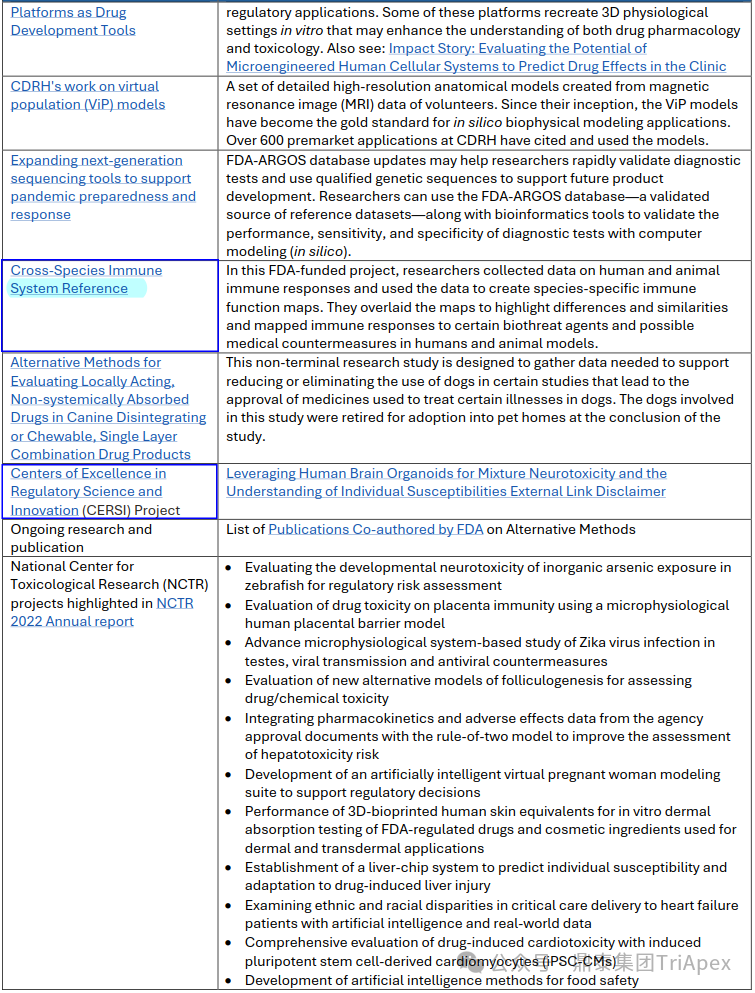
◆ 人类器官芯片用于辐射对策开发
科学家们正在开发肺、肠道和骨髓器官芯片模型,用以模拟辐射损伤。
这些模型被用来测试治疗这种损伤的医疗对策。
研究扩展到开发和评估新的器官芯片,以帮助开发针对 COVID-19 的对策。
◆ CFSAN 在器官芯片技术方面的工作
CFSAN 科学家从肝芯片开始,评估这项技术的有效性,以便更好地理解食品中化学物质对人体的影响。
◆ 3D 细胞培养或微生理学平台(MPS)
CDE研究人员正在审 NAMs,包括 MPS,这些平台提供了额外的、某些情况下更聚焦的安全性信息,帮助申请人扩展体内数据。
◆ 跨种属免疫系统参考
研究人员收集人类和动物免疫反应的数据,利用这些数据创建种属特异性免疫功能图
将图谱叠加以突出差异和相似性,并在人类和动物模型中绘制对某些生物威胁剂 biothreat agents 的免疫反应和可能的医疗对策。
表1. FDA 推进替代方法的尝试

此外,FDA 还有多个工作组支持推进替代方法并减少动物试验:
◆ FDA 替代方法工作小组 FDA Alternative Methods Working Group
FDA 于 2019 年成立了替代方法工作小组,旨在进一步推进《FDA 预测毒理学路线图 Predictive Toxicology Roadmap》的目标。该小组由来自所有中心及监管事务办公室(ORA)的高级审评员和研究人员组成。小组关注创新技术和新科学领域的机会,这些机会支持跨越 FDA 产品和监管领域的替代方法。
◆ 建模与仿真工作小组 Modeling and Simulation Working Group
建模与仿真工具补充了收集关于 FDA 监管产品的证据的传统方法,并支持跨中心开发 FDA 政策。关键目标包括:提高对建模与仿真的认识,以促进监管科学的进步;增强利益相关者之间的关于建模与仿真工作的沟通;作为 FDA 在建模、仿真和新兴技术方面的科学资源;与从事类似活动的国家和国际组织合作;通过建模与模拟促进整个 FDA 内部的一致审查和决策。
◆ FDA 毒理学工作小组 FDA Toxicology Working Group
该小组于 2017 年发布了《FDA预测毒理学路线图》,阐述了 FDA 对于发展和评估新兴毒理学方法和新技术的看法。小组成员包括 FDA 各中心和办公室的资深毒理学家。已经举办了公共活动,包括 2018 年的公开听证会和 2019 年的公开研讨会。
该指导原则中提到了某些治疗领域的新药(特别是罕见病)有时较大程度依赖非临床研究结果。临床研究中剂量选择的依据可源于动物研究和/或类器官、分子等体外研究结果。


本文借助 FDA NAMs 网络会议主题报告,讨论了 FDA 当前关于动物使用的规定及其在决策中的机会,强调了 NAMs 在减少动物试验中的潜力。FDA 鼓励使用 NAMs,并指出这些方法可以为个别产品监管决策提供重要证据。尽管某些指导原则仍要求进行动物试验,在特定情况下,NAMs 可以加速替代动物试验的机会。FDA 与国际机构合作,推动科学进步,并继续利用现有技术,同时探索新的替代方法,如系统生物学、人工智能和微生理系统等。CDE 也在《模型引导的罕见病药物研发技术指导原则(征求意见稿)》中指出:基因、分子、细胞、类器官、器官芯片和动物研究数据均可作为非临床研究数据来源;类器官和器官芯片作为 NAMs,被明确可作为临床研究中剂量选择的依据。这些努力旨在提高药物开发效率,并减少对动物试验的依赖。

























