


2024年2月,EMA和BioNtech、Moderna、Ionis、Silence、Alnylam等致力于RNA药物研发的企业共同发表了题为《Report of the European Medicines Agency Conference on RNA-Based Medicines》的文章,详细报告了EMA于2023年2月2日举办的RNA药物网络会议的相关内容。
Regulatory and scientific virtual conference on RNA-based medicines

会议背景和目的
本次会议吸引了超过1000名参与者,涵盖了学术界、工业界、监管机构和患者组织等多个利益相关方。
该会议聚焦RNA技术(不包括RNA疫苗)在制药领域的应用及其监管挑战,涉及RNA技术的最新进展、化学制造与控制、非临床研究和临床试验等相关议题。会议由主题演讲和讨论环节组成,旨在探讨RNA药物研发面临的科学和监管机遇与挑战,促进工业界与监管机构之间的对话,识别监管科学的空白并寻找解决方法。
★ 文章导览 ★
Session 1 | State of the Art of RNA Technologies |
Session 2 | Chemistry, Manufacturing, and Controls Aspects of RNA Technologies |
Session 3 | Nonclinical Aspects of RNA Technologies |
Session 4 | Session 4 Clinical Aspects of RNA Technologies |
Session 5 | Panel Discussion |
Session 1:
State of the Art of RNA Technologies
(1) 监管现状
Sol Ruiz (AEMPS)总结了EMA已批准或受理的RNA药物、监管挑战以及监管机构如何支持RNA药物研发的情况。
与小分子化药和生物技术药物已有明确的指导原则不同,目前监管机构对于RNA药物的经验主要来自COVID-19 mRNA疫苗。从不同的监管角度,对RNA药物的定义尚未达成共识,根据其特性和生产方式,可被视为化学品或生物制品。截至会议召开时,欧盟共有111项孤儿药认定、24项儿科研究计划,以及13项上市申请(其中已有10种ASO和siRNA获批上市)。


EMA和 ICH 对于 RNA 药物的定义尚未统一(引自Sol Ruiz)
(2) RNA药物研发面临的挑战
Tal Zaks(Orbimed)分析了RNA药物开发面临的挑战,如:对于RNA药物的定义模糊,是否属于基因疗法尚无明确标准,基于核酸结构还是作用机制进行分类?RNA药物药理学效应不仅由其核苷酸序列决定,还由分子骨架决定。支持RNA药物上市所需证据水平尚未达成共识,以及如何利用真实世界证据等。

RNA药物开发面临的挑战(引自Tal Zaks)
为了从mRNA和ASO药物开发的失败中吸取教训,有必要发表其阴性试验结果。特别是对于ASOs,在临床前研究中包含适当的对照至关重要,并考虑临床前模型的临床转化价值。建议出台关于质量和非临床数据要求的指导原则。
(3) 讨论了关于“平台”的话题
精确定义平台很重要,过于宽泛的定义(例如涵盖所有mRNA和RNA的疗法)可能会失去指导价值。建议基于共同机制(如剪接调节、给药途径和化学修饰)的平台定义可能更有价值。讨论中还强调,监管机构正在发挥合作、知识分享和推动者的作用,特别是在安全风险和不良事件方面。新的欧盟药品管理法规将包含关于平台的条文。
(4) 新的研究方向
目前,高效递送仅限于肝脏(通过皮下注射给予LNP-RNA或GalNac-RNA)、中枢神经系统(经鞘内注射给药)和眼睛(经眼内注射给药)。演讲者指出,RNA技术的未来潜力领域包括使用新型递送系统将RNA递送到特定组织,如大脑和肺部。如对于ASOs,在特定组织中的疗效取决于能否实现有效的靶向递送。
RNA技术有望推动个性化治疗的发展,如基因编辑和用于肿瘤治疗的分子。会议讨论了有助于促进ASO药物开发的技术进步,如生产工艺和规模放大的改进对于ASO和mRNA药物的临床实施至关重要。从诊断角度来看,核苷酸测序成本的大幅下降提高了筛选出可从RNA药物治疗中获益的罕见疾病患者的可能性。Annemieke Aartsma-Rus (Leiden University Medical Center)分享了Milasen的案例,这是一种以剪接调节为作用机制的ASO,用于1名罕见病儿童的个性化治疗。这一案例启发了全球研究人员开发个性化ASO(n-of-1 clinical trial)。

Milasen 个性化治疗 ASO(引自Annemieke Aartsma-Rus)
展望未来,创新技术的发展提高了新药可及性,且随着生产规模的扩大,预计成本也会进一步降低。借助生物信息学软件,还可以对RNA结合和可能的脱靶效应进行预测,从而推动临床前开发,增加设计安全、有效的RNA疗法的机会。
Session 2: Chemistry, Manufacturing, and Controls Aspects of RNA Technologies
2022年6月,EMA发布了《Draft Concept Paper on the establishment of a Guideline on the Development and Manufacture of Synthetic Oligonucleotides》,涵盖以下主要内容:基于相关关键质量属性制定整体控制策略,以确保寡核苷酸药物的质量一致性;针对固相合成工艺路线的具体要求,包括批次定义,纯化过程中所采用的分批、混批和重新加工步骤;起始物料的选择、杂质限度的制定;表征方法等。截至 2022 年 12 月 20 日,共收到 61 条反馈意见,关注度较高的反馈意见集中在杂质控制策略和质量标准、可比性研究、分析方法、灭菌工艺和平台经验等。

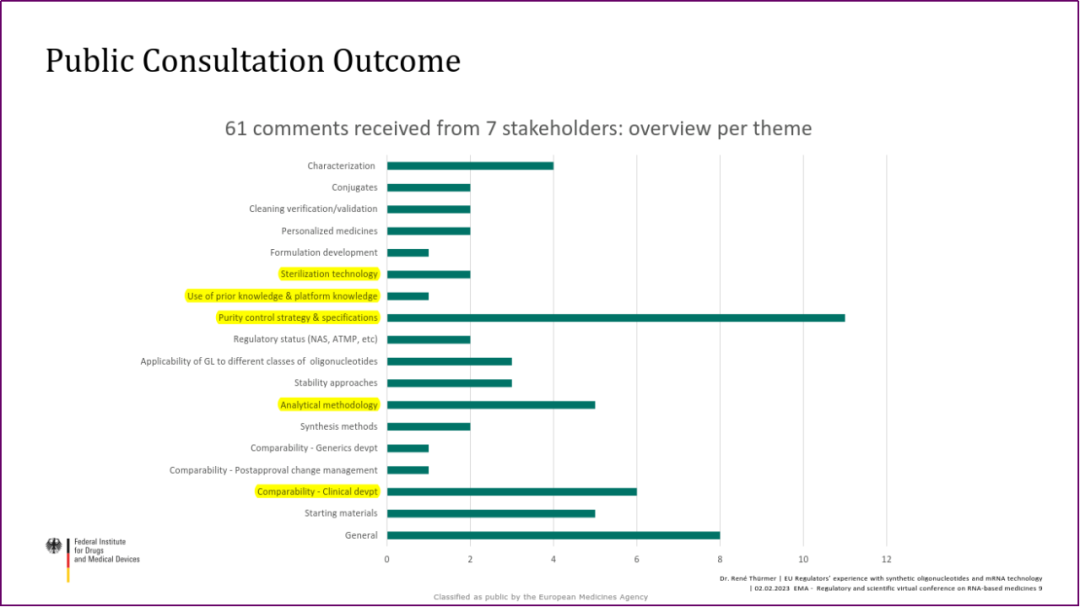
EMA 寡核苷酸药物工艺开发、生产文件及反馈意见(Dr. René Thürmer)
(1) 杂质控制策略
在杂质控制策略方面,建议的报告限度为0.20%,鉴定限度为1.0%(与前期内容中的观点一致,点击以下链接查看全文:siRNA药物非临床研究价值的延伸 —— 杂质控制)。
尽管随着分析技术的发展,上述建议可能会发生变化(如EMA已经收到报告限度为0.10%的SA申请),多个已获批上市的寡核苷酸治疗药物均采用了上述限度。鉴定限度决定了由质量预期而非安全性担忧驱动的API中非特定杂质的水平。质量期望是当质量控制策略均已按预期执行时,API中的非特定杂质被控制在鉴定限度以内。对于寡核苷酸,业界认为1.0%的鉴定阈值是可实现的最佳水平。例如,当起始物料中存在新的反应性杂质时,可能导致API中非特定杂质的产生,由于多重性和起始物料分析方法的局限性(尤其是在准确度和定量限方面),将API杂质控制在1.0%以下可能非常具有挑战性。其他条件相同时,寡核苷酸越长,对最终API中产生的杂质的控制越困难。
(2) 灭菌工艺
目前,寡核苷酸行业备受关注的监管主题是终端灭菌的必要性、起始物料的选择与论证、纯度控制策略以及溶液活性药物成分(API)的概念等。EMA关于终端灭菌的指导原则适用于寡核苷酸。对于亲水性产品,可参考决策树考虑湿热灭菌法,并使用热力学最稳定的处方和代表性的包材进行可行性评估。Aptamers、蛋白质偶联的寡核苷酸和siRNAs不适合终端灭菌。不论是哪种类型的产品,均需提供无菌过滤和灭菌工艺的合理性证明。必须考虑终端灭菌对检测、降解产物以及其他质量属性(如颗粒物)和外观的影响。对于某些类型的寡核苷酸,建议基于风险评估选择合适的灭菌工艺。
(3) 监管对于“平台经验”的态度
针对寡核苷酸,有公司提出将前期经验和平台方法用于验证分析方法和稳定性。挑战在于如何定义平台的边界以及如何记录。尽管监管机构尚缺乏对基于mRNA技术的平台经验,但在提供适当的合理性证明的前提下,对作为稳定性策略和工艺验证策略一部分的平台和前期经验持开放态度。
(4) 对于EMA指导原则的展望
EMA的寡核苷酸指南草案将在考虑利益相关方意见后计划于2023年底至2024年初发布征求意见稿。EPOC目前正在撰写关于可比性研究、高级结构和聚体、平台数据、稳定性和微生物控制策略的文章。这些文章中提议的方法即使最终未被监管机构采用,仍然是有意义的,因为他们有助于触发监管机构和行业之间的对话。

European Pharma Oligonucleotide Consortium (EPOC) 成员(引自 Daniel Capaldi)
(5) 其他
尽管会议主题中将mRNA疫苗排除在外,仍讨论了多价mRNA产品分析方面的挑战。对于这类产品,需要综合考虑鉴定试验和比例的选择。此外,还讨论了常规活性检测的必要性,即如果通过基于细胞的方法证明mRNA编码的抗原能够正确表达,那么可以合理地使用一系列功能分析(物理化学和免疫学)试验作为活性检测的替代方法。关于mRNA疫苗质量的EMA指南草案的概念文章已按原定计划于2023年发布。

EMA 关于 mRNA 疫苗质量研究概念文件
下期更精彩,敬请关注——
Session 3:Nonclinical Aspects of RNA Technologies
Session 4:Clinical Aspects of RNA Technologies
Session 5:Panel Discussion
参考资料:
[1] Falk Ehmann, Andreas Kuhn, Anna Maria Gerdina Pasmooij, et al.
Report of the European Medicines Agency Conference on RNA-Based Medicines[J]. Nucleic Acid Ther . 2024 Feb;34(1):4-11.
doi: 10.1089/nat.2023.0021. Epub 2024 Jan 4.
























