


2022年
抗VEGF药物治疗
眼内新生血管疾病的研究进展
Research progress
眼内新生血管的形成是多种眼部疾病的病理基础和临床表现,由于它的内皮细胞间结构异常,管壁已渗出、出血、以及伴有纤维结缔组织增生等一系列病变严重破坏眼的结构和功能,是引起患者视力下降和致盲的重要原因。最常见的有年龄相关性黄斑变性(age-related macular degeneration, AMD)、糖尿病性视网膜病变(diabetic retinopathy,DR)、视网膜静脉阻塞(retinal vein occlusion,RVO)、新生血管性青光眼(neovascular glaucoma,NVG)和早产儿视网膜病变(retinopathy of prematurity,ROP)等疾病。
新生血管形成的具体机制尚未完全明确,是多因子、多途径共同参与的复杂过程。生理状态下眼内局部微环境中的促血管生成因子与抑制血管生成因子之间保持动态平衡,生成正常血管,而在缺血、缺氧、炎症等病理因素诱导下,细胞间因子的动态平衡被打破,促使新生血管生成,其中VEGF是作用最强、最直接的细胞因子之一。
VEGF是血管内皮细胞特异性的肝素结合生长因子,可在体内诱导血管新生。它最早于1989 年从牛的垂体滤泡星状细胞培养液中分离纯化,为同源二聚体糖蛋白,有5个等型,即VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E。VEGF的主要生理功能有:
1) 增加血管尤其是微细血管的通透性,使血浆大分子(血浆蛋白、纤维蛋白原)外渗并沉积在血管外的基质中,为肿瘤细胞的生长和新生毛细血管网的建立提供营养物质和基质。
2) 选择性增强血管内皮细胞有丝分裂,刺激内皮细胞增殖并促进血管的形成。
3) 促进肿瘤转移,肿瘤的增殖和转移依赖 VEGF使血管内皮细胞分泌胶原酶和纤溶酶原,借以降解血管基底膜;同时,肿瘤组织内部新形成的微血管基膜不完善,这 种性质使肿瘤易于进入血液循环中。
4) 抑制人体的免疫功能和反应,促进肿瘤的浸润与转移。
5) 诱导上皮细胞间隙出现及开窗现象,活化上皮细胞的胞质小泡及细胞器,并直接刺激内皮细胞释放蛋白水解酶,降解基质,释放更多的VEGF,加速肿瘤的发展;细胞外蛋白酶又可激活细胞外基质的结合性VEGF的释放。
6) 淋巴内皮细胞的生长与血管内皮细胞相似,均要接受VEGF等细胞因子的调控,VEGF同样可能促进肿瘤周围淋巴管增生,加速淋巴结转移。
基于VEGF的生理、病理作用,抑制VEGF成为新生血管及血管性眼底疾病的重要靶点,2004年2月26日,第一个抑制VEGF的抗肿瘤药贝伐珠单抗(治疗转移性结肠癌、直肠癌)获得FDA批准,于2005年报道首次用于治疗AMD,抗VEGF药品的上市情况见表1。
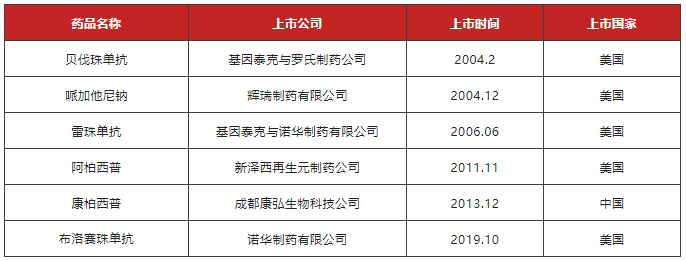
表 1 抗VEGF药品上市概况
贝伐珠单抗作为一种超说明书药物通过玻璃体腔注射治疗,与雷珠单抗在改善患者视力和视网膜水肿方面疗效相似,且成本较低,但是由于分装等问题存在一定安全风险。哌加他尼钠是第一个用于治疗新生血管性眼病的VEGF抑制剂,2004年12月被FDA批准用于AMD,但是实际的临床应用中发现哌加他尼钠并不能稳定患者的视力,只能延缓进展,许多患者在治疗后仍旧丧失了视力。布洛赛珠单抗国内暂未批准,国内市售主要为雷珠单抗、阿柏西普及康柏西普3款,国内正在开展的抗VEGF药物临床试验颇多,进展较快的有齐鲁制药、百奥泰和迈威生物,详见下表2。
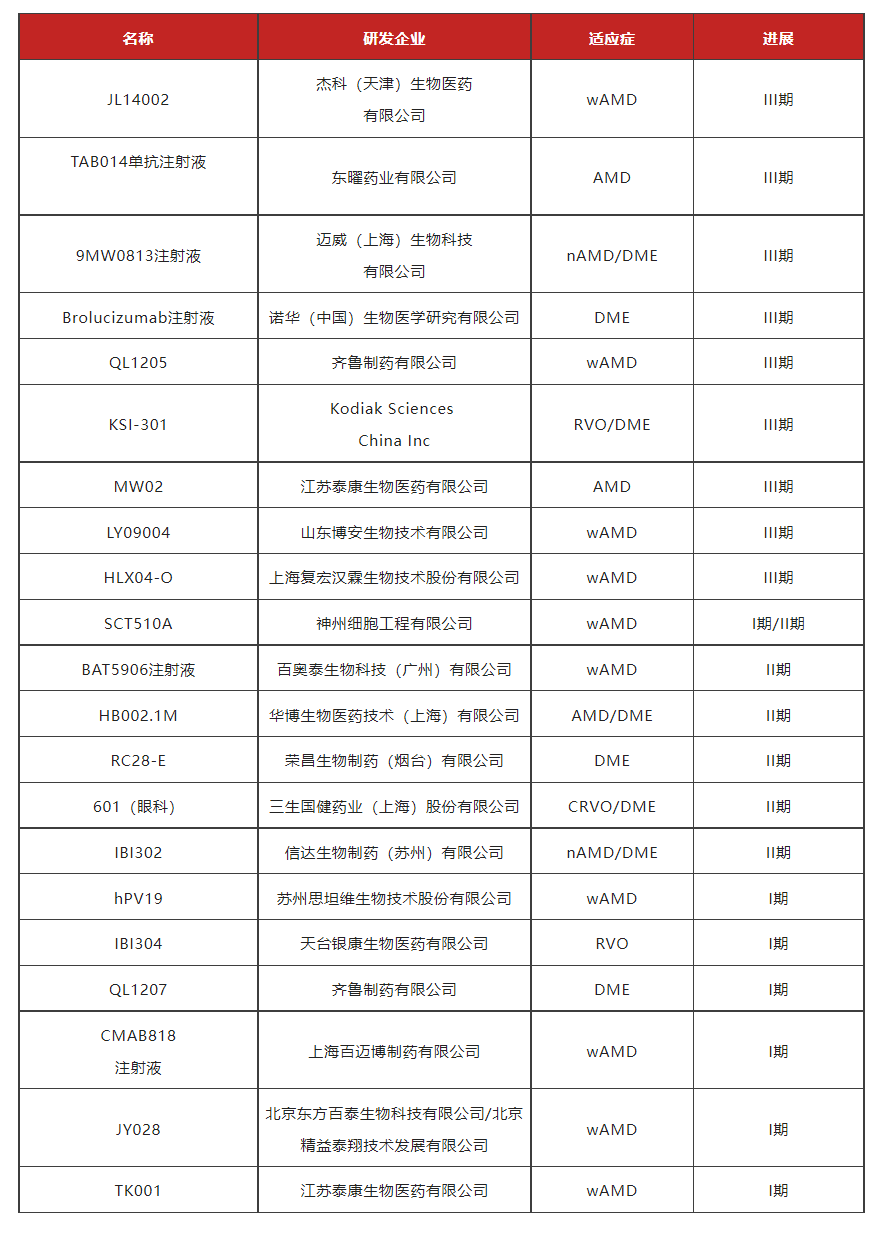
表 2 国内正在开展的抗VEGF药物临床试验概况
实际的临床应用过程中,雷珠单抗、阿柏西普及康柏西普在使用一段时间后均会产生耐药性,眼内新生血管的形成是多种眼部疾病的共同病理改变,抗VEGF并非唯一的血管增生发病机制,除此之外血小板衍生因子(PDGF)和血管生成素(Angs)等都被证明与血管的生成相关。目前针对血管新生分子机制如PGF、PIGF、Ang2等都是研究的热点,以期通过多靶点共同调控达到更佳治疗目的。
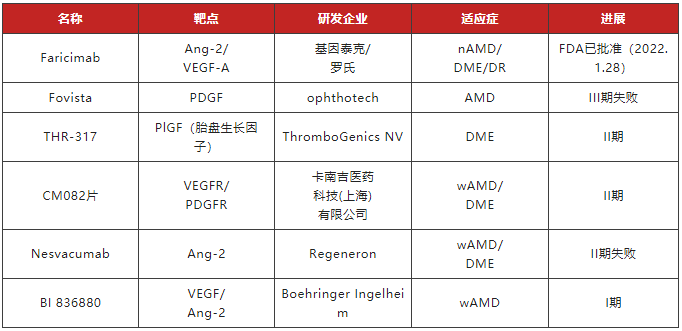
表3 在研新生血管性眼病抗体药物
参考文献
[1] 血管内皮生长因子拮抗剂治疗眼内新生血管性疾病研究进展[J]. 杨娟,张美霞,张军军.国际眼科杂志,2007年第006期,1677-1680.
[2] 新生血管性眼病发病相关细胞因子研究进展[J]. 韩梦雨.中华实验眼科杂志,2018年36卷8期, 636-642页.
[3] 抗血管内皮生长因子的药物研究进展与临床评价[J].张石革.中国医院用药评价与分析.2014年11期, 964-967页.
[4] 靶向血管内皮生长因子治疗眼新生血管的研究进展[J].孙靖,李筱荣.眼科新进展,2008年28卷1期, 65-68页.

